Infections à Parechovirus (PEV) : des infections du nouveau-né et du nourrisson méconnues et parfois évocatrices de sepsis bactérien
Marion Jeannoël1, Audrey Mirand2, Cécile Henquell2, Isabelle Schuffenecker1
1 CNR entérovirus et parechovirus – laboratoire coordonnateur, Institut des Agents Infectieux, Hospices civils de Lyon
2 CNR entérovirus et parechovirus – laboratoire associé, service de Virologie, CHU de Clermont-Ferrand
marion.jeannoel@chu-lyon.fr ; amirand@chu-clermontferrand.fr ; chenquell@chu-clermontferrand.
Introduction
- Comme les Enterovirus (EV), petits virus à ARN nus appartenant à la famille des Picornaviridae
- Mise en évidence du rôle du PEV-3 comme agent de méningites et de sepsis du nouveau-né et du jeune nourrisson depuis 10 à 15 ans
- En France, malgré le développement progressif des capacités diagnostiques et la surveillance épidémiologique des infections par le CNR des Enterovirus et Parechovirus, les infections à PEV sont encore méconnues et sous-diagnostiquées
Epidémiologie
Epidémiologie encore imparfaitement connue. Variation prévalence selon type d’étude (surveillance longitudinale, description d’épidémies), âge des patients, présentation clinique, prélèvements analysés.
Parmi les 19 types de PEV actuellement identifiés, le PEV-1 est le plus souvent détecté dans des prélèvements de selles ou respiratoires en association avec des tableaux digestifs et/ou respiratoires bénins. Le PEV-3 est le type le plus fréquemment détecté dans les tableaux de méningites et de sepsis du jeune nourrisson de moins de 3 mois. Les PEV de type 4, le type 6 et plus récemment le type 5 ont été occasionnellement détectés dans des tableaux fébriles du nourrisson.
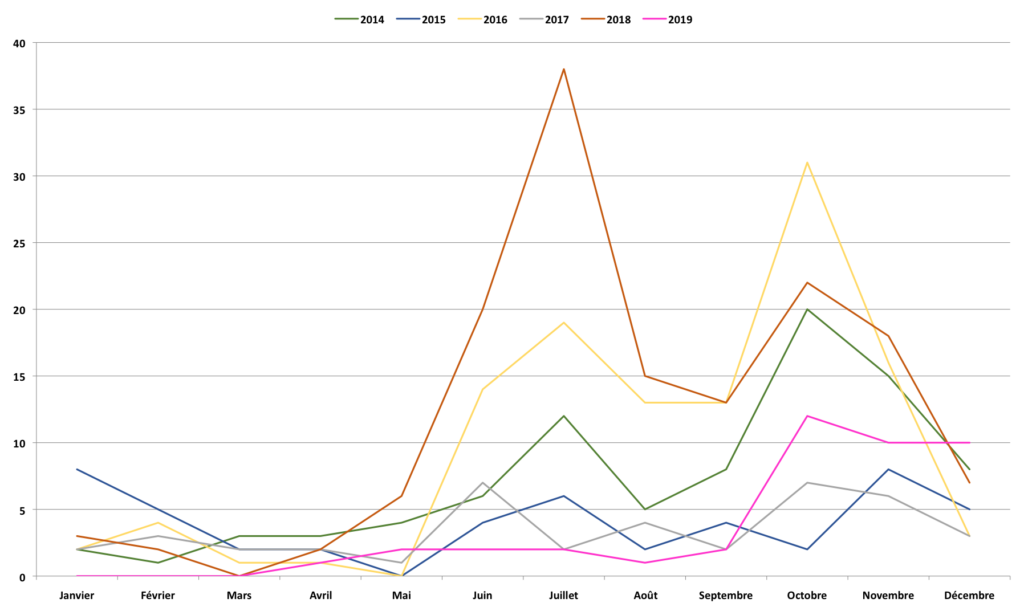
En France : depuis 2012, on observe une augmentation bisannuelle du nombre d’infections à PEV chez les enfants de moins de 3 mois hospitalisés pour tableau de méningite et/ou sepsis avec 2 périodes de détection (Juin-Juillet et Octobre-Novembre). Au pic épidémique, les PEV pourraient représenter jusqu’à 30% des virus détectés dans les LCR des enfants de moins de 3 mois. Ces tableaux sont principalement causés par le PEV-3.

Expression clinique
Les infections à PEV sont avant tout des infections pédiatriques. Elles sont majoritairement a- ou pauci-symptomatiques mais peuvent être associées à des tableaux sévères chez le jeune nourrisson. Des données récentes de détection moléculaire par PCR dans une large cohorte d’adultes hospitalisés au CHU d’Amsterdam et les données de séro-prévalence (Japon, Europe) suggèrent que les infections de l’adulte sont rares et bénignes.
Tableaux fébriles et méningites du nourrisson
- PEV-3 : 2e étiologie virale (après les EV) associée à des tableaux de sepsis et de méningite du nourrisson de moins de 3 mois (âge médian entre 31 et 46 jours selon études)
- Présentation clinique la plus fréquente : fièvre (>39°), irritabilité importante, geignements +/- abdomen ballonné, éruption maculo-papuleuse palmo-plantaire +/- signes de défaillance hémodynamique
- Durée fièvre plus longue chez patients avec infection à PEV par comparaison avec patients avec EV
- Sévérité des signes cliniques peut évoquer un sepsis bactérien
- 5 à 10% des cas hospitalisés en soins intensifs pour défaillance hémodynamique et/ou respiratoire
- Cytochimie LCS normale chez plus de 50% des patients
- Leucopénie chez 40-60% des enfants, plus profonde chez les enfants avec forme grave
- CRP le plus souvent normale
Tableaux d’encéphalite du nourrisson
- Rares tableaux de convulsions avec atteinte de la substance blanche sous-corticale à l’IRM
- Facteurs de risque : prématurité et très jeune âge au diagnostic (âge médian : 13 jours)
- Risque de séquelles neuro-développementales à long terme pouvant survenir même chez des enfants avec absence de séquelles à la sortie d’hospitalisation : nécessité d’un suivi à long terme
Autres manifestations cliniques
- Tableaux digestifs et respiratoires bénins de l’enfant (PEV-1)
- Epidémies récurrentes de myalgie/myosite chez adultes au Japon (PEV-3)
- Possibilité myocardite et/ou encéphalite chez enfants ou adultes avec immunosuppression
Physiopathologie
- Sites primaires réplication : cellules épithéliales tractus respiratoire et digestif
- Transmission féco-orale ou respiratoire avec risque majoré de transmission dans les fratries avec jeunes enfants
- Transmission materno-fœtale possible en fin de grossesse
- Physiopathologie peu connue. Pas de modèle animal. Réplication démontrée des PEV-1 et 3 dans l’épithélium nasal (modèle Mucilair) avec activation gènes réponse immunitaire innée et inflammatoire très supérieure pour le PEV-3. Récepteurs possibles des PEV : intégrines, héparane sulfate, beta 2 microglobuline
- Hypothèses visant à expliquer la plus grande sévérité des infections à PEV-3 : faible séroprévalence (liée à émergence récente du virus) et/ ou faible capacité neutralisante des Ac anti-PEV-3 chez les femmes en âge de procréer, induction d’une réponse inflammatoire plus importante, neurotropisme lié à l’utilisation d’un récepteur différent pour le PEV-3
Diagnostic (Figures 2 et 3)
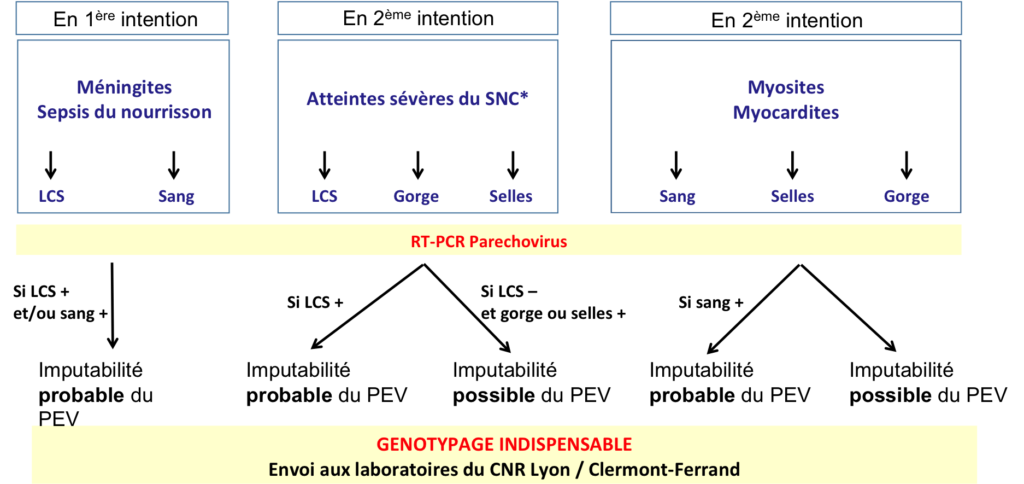
Techniques diagnostiques
- RT-PCR monoplex ou multiplex (région 5’ non codante; pas de croisement avec les EV)
- La généralisation des techniques multiplex (panels méningites ou méningo-encéphalites) offre la possibilité d’une recherche plus systématique des PEV dans les LCS
Etat des lieux sur le diagnostic en France métropolitaine
Majoritairement réalisé dans des laboratoires de CHU (60% des laboratoires du réseau de surveillance des EV opérationnels pour le diagnostic moléculaire contre 10% en 2012)
Traitement
- Pas de traitement anti-viral spécifique
- Piste envisagée de la sérothérapie avec des Ac spécifiques anti-PEV-3
Conclusions
- Les infections à PEV sont encore méconnues et sous-diagnostiquées.
- Les PEV doivent faire partie du diagnostic différentiel des tableaux de méningites et de sepsis du nouveau-né et du nourrisson de moins de 3 mois, au même titre que les EV et les Herpes Simplex Virus
- Le PEV-3, d’émergence récente, est le type le plus fréquemment identifié dans les tableaux cliniques sévères du très jeune enfant et la compréhension de la spécificité de son pouvoir pathogène est en cours d’élucidation
- La généralisation des techniques multiplex (panels méningites ou méningo-encéphalites) offre la possibilité d’une recherche plus systématique des PEV. Comme pour les EV, le diagnostic moléculaire rapide peut permettre de réduire la durée d’administration des antibiotiques et la durée d’hospitalisation
- Le génotypage est réalisé au titre de la surveillance épidémiologique. Il permet le suivi des types circulants et la meilleure connaissance du pouvoir pathogène associé aux différents types
- Quelle épidémiologie en 2020 ? Même si l’augmentation bisannuelle des PEV n’a pas encore été détectée (effet probable du confinement), restons vigilants…
En savoir plus…
- Olivje L, Lennings L, Walls T. Human parechovirus : an increasingly recognized cause of sepsis-like illness in young infants. Clin Microbiol Rev 2017 ; 31 :pii :e00047-17
- Aizawa Y, Izumita R, Saitoh A . Human parechovirus type 3 infection : an emerging infection in neonates and young infants. J Infect Chemother 2017 ;23 : 419-26
- Esposito S, Rahamat-Langendoen, J, Ascolese B, Senatore L, Castellazzi L, Niesters HGM. Pediatric parechovirus infections. J Clin Virol 2014 ; 60 :84-89
- Karelehto E, Cristella C, Yu X, Sridhar A, Hulsdouw R, de Haan K, van Eijk H, Koekkoek S, Pajkrt D, de Jong MD, Wolthers KC. Polarized entry of the human parechoviruses in the airway epithelium. Front Cell Infect Microbiol. 2018 Aug 22;8:294. doi: 10.3389
- Brouwer L, Wolthers KC, Pajkrt D. Parechovirus A prevalence in adults in The Netherlands. Arch Virol. 2020;165(4):963-966. doi:10.1007/s00705-020-04547-0