Octobre 2020
Aspergillus fumigatus
REGNE : Fungi
PHYLUM : Dikarya, Ascomycota, Pezizomycotina
CLASSE : Eurotiomycètes
ORDRE : Eurotiales
FAMILLE : Aspergillaceae
Les Aspergillus sont des champignons filamenteux appartenant au groupe phylogénétique des Ascomycètes. Au sein du genre Aspergillus qui comprend plus de 300 espèces, Aspergillus fumigatus est l’espèce la plus fréquemment incriminée en pathologie humaine. Elle a donc fait l’objet d’un très grand nombre de travaux, aussi bien fondamentaux avec l’identification des facteurs de virulence du champignon qu’appliqués (études cliniques, diagnostic biologique et thérapeutique des aspergilloses).
Aspergillus fumigatus est avant tout un saprophyte ; il est retrouvé dans le sol et l’eau où il se nourrit des matières organiques en décomposition. Ce champignon cosmopolite est également ubiquitaire puisqu’on le rencontre aussi bien en ville qu’à la campagne, et aussi bien à l’extérieur qu’à l’intérieur des habitations. Ses grandes capacités de résistance et de dispersion dans l’environnement sont favorisées par la structure particulière de ses spores (ou conidies) de très petite taille (2 à 3 µm de diamètre), dont la paroi mélanisée est tapissée de protéines hydrophobes. Sa thermotolérance importante lui permet de croître à des températures élevées (jusqu’à 55°C), et ainsi de survivre et se développer chez les mammifères thermophiles, et notamment chez l’homme. La virulence de cette espèce repose également sur la capacité d’adhésion de ses spores aux membranes basales, sa production de toxines (fumagilline, brévianamide, fumitrémorgine, pseurotine, pyripyropène, fumigatoxine, …), et ses capacités d’échappement au système immunitaire (mélanine, gliotoxine, …).
Chez l’homme, A. fumigatus est incriminé dans un large spectre de maladies, majoritairement respiratoires, et le tableau clinique est fonction du statut immunitaire de l’hôte et de l’existence ou non de lésions pulmonaires initiales. Chez l’individu sain, les spores d’A. fumigatus continuellement inhalées sont rapidement éliminées par la clairance muco-ciliaire et la phagocytose assurée par les cellules de l’immunité innée, macrophages et polynucléaires neutrophiles. Chez l’immunocompétent, en présence de facteurs favorisant la colonisation prolongée des voies respiratoires comme dans la mucoviscidose, des formes immunoallergiques telle que l’aspergillose broncho-pulmonaire allergique peuvent survenir. Sur une cavité pulmonaire résiduelle post-tuberculose ou cancer du poumon, une greffe aspergillaire peut aboutir à un aspergillome. A l’inverse, chez des individus profondément immunodéprimés (hémopathies malignes, transplantations d’organe solide…), le tableau clinique évolue rapidement vers une forme aiguë angio-invasive ou aspergillose pulmonaire invasive, de pronostic très péjoratif. Le diagnostic précoce de cette infection cliniquement peu caractéristique, est crucial pour la mise en place immédiate d’un traitement antifongique appropriée, afin de limiter la mortalité associée à cette pathologie.
Sur le plan mycologique, A. fumigatus est facilement isolé en culture à partir d’échantillons cliniques. Aspergillus fumigatus produit rapidement (24 à 72 h) sur milieu de Sabouraud à 37°C des colonies poudreuses d’abord blanches, puis vert-bleutées, virant ensuite au vert foncé et enfin au gris en vieillissant. Le verso est généralement incolore. La croissance est inhibée par le cycloheximide.
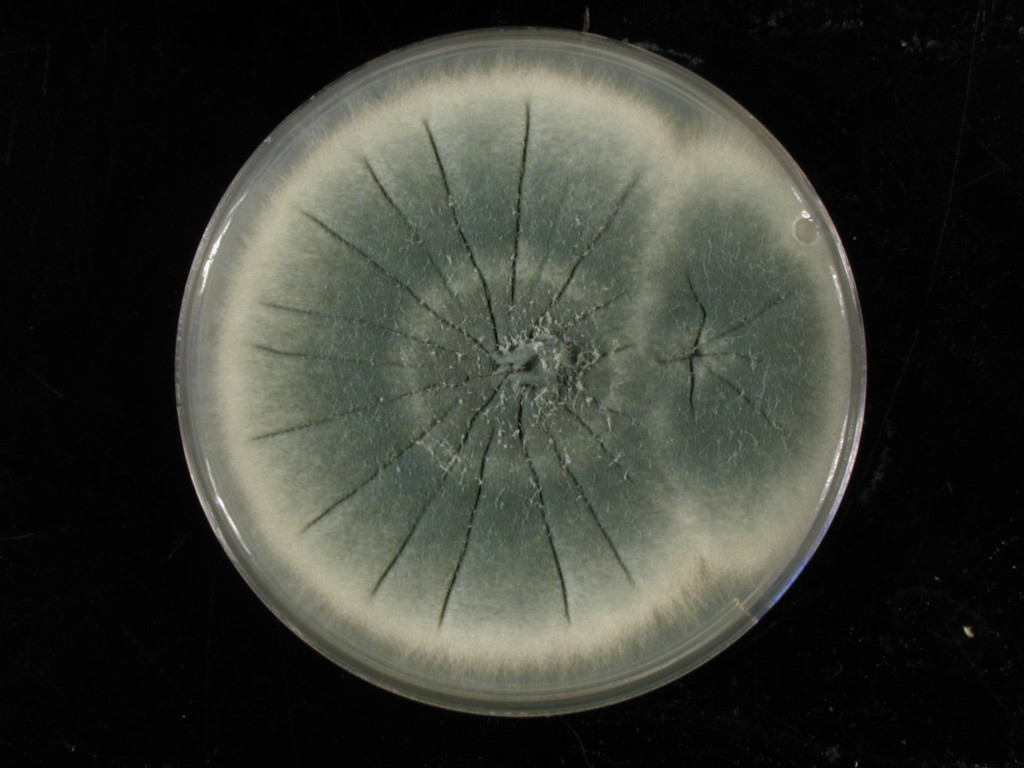
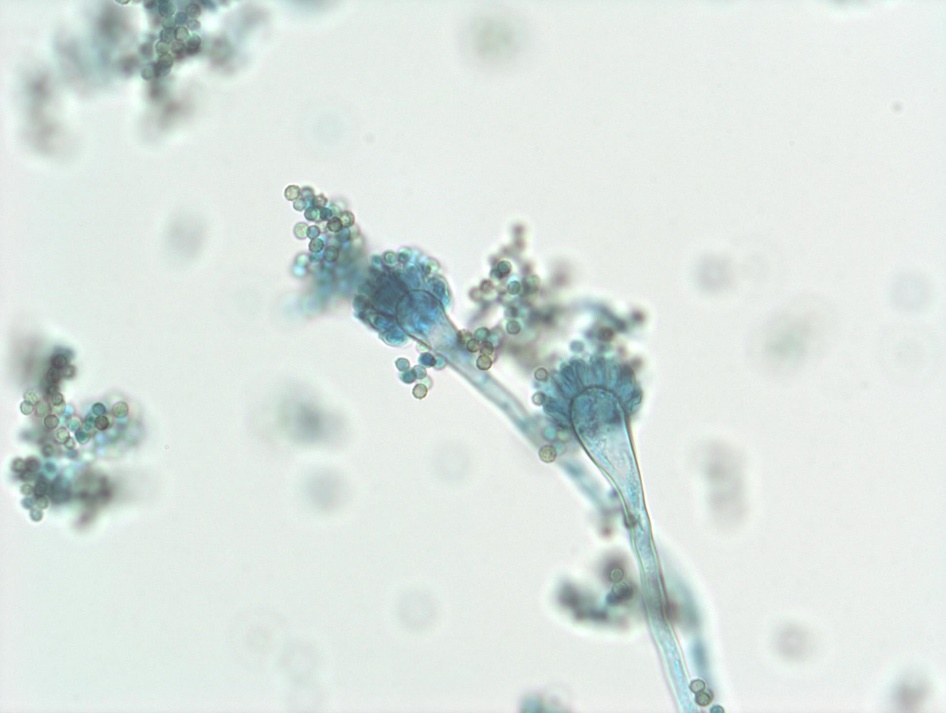
A l’examen microscopique, A. fumigatus est reconnaissable à ses têtes aspergillaires unisériées, en colonne compacte. La vésicule hémisphérique, située à l’extrémité d’un conidiophore court, lisse et hyalin, et s’évasant progressivement à son sommet, porte une rangée unique de phialides, qui produisent par bourgeonnement à leur sommet toute une série de conidies rondes, lisses et de petite taille (2-3 µm), disposées en chaînes. Cependant la microscopie ne permet l’identification du champignon qu’au niveau de la section ‘Fumigati’, sans pouvoir discriminer de façon fiable A. fumigatus sensu stricto, d’autres espèces morphologiquement très proches, comme Aspergillus lentulus ou Aspergillus felis. La spectrométrie de masse de type MALDI-TOF qui a beaucoup évolué ces dernières années avec l’enrichissement des bases de données, tend à supplanter l’identification morphologique. L’identification moléculaire repose sur le séquençage des régions ITS (internal transcribed spacer) 1 et 2 des ADN ribosomaux pour l’identification de la section, et du gène de la bêta-tubuline ou de la calmoduline pour l’identification de l’espèce.
Il est important de tester la sensibilité des isolats cliniques aux antifongiques. L’amphotéricine B est fongicide, alors que les triazolés (itraconazole, voriconazole, posaconazole et isavuconazole) et les échinocandines sont fongistatiques sur A. fumigatus. L’émergence de souches d’A. fumigatus résistantes aux triazolés initialement rapportée en Europe du Nord, est également observée dans une moindre mesure en France (environ 3% des isolats). Résultant de la pression de sélection induite soit par un traitement prolongé par azolés, soit par l’utilisation de fongicides triazolés dans l’agriculture (propiconazole, bromuconazole, tébuconazole, époxiconazole, difénoconazole, …), ce phénomène pourrait mettre en péril la prise en charge thérapeutique des patients, et par conséquent, suscite actuellement des recherches actives.
Pour plus d’informations, consulter :
- Guegan H, Chevrier S, Belleguic C, Deneuville E, Robert-Gangneux F, Gangneux JP. Performance of molecular approaches for Aspergillus detection and azole resistance surveillance in cystic fibrosis. Front Microbiol. 2018;9:531. doi: 10.3389/fmicb.2018.00531.
- Guegan H, Robert-Gangneux F, Camus C, Belaz S, Marchand T, Baldeyrou M, Gangneux JP. Improving the diagnosis of invasive aspergillosis by the detection of Aspergillus in broncho-alveolar lavage fluid: Comparison of non-culture-based assays. J Infect. 2018;76(2):196-205. doi: 10.1016/j.jinf.2017.11.011.
- Latgé JP, Chamilos G. Aspergillus fumigatus and aspergillosis in 2019. Clin Microbiol Rev. 2019;33(1): e00140-18. doi: 10.1128/CMR.00140-18.
Jean-Pierre Gangneux et Hélène Guegan
(Université de Rennes 1, Centre Hospitalier Universitaire de Rennes)









