MODULATION DU MICROBIOTE INTESTINAL : VERS UNE MEDECINE PERSONNALISEE
(Mise à jour le 28 octobre 2020, en rouge)
Le microbiote intestinal (MI) humain représente un écosystème dense, complexe, dynamique et versatile. Les nombreuses études publiées ces dernières années ont clairement montré qu’il n’avait pas juste un rôle dans la digestion des aliments et que son impact sur la santé et le bien-être de son hôte était essentiel. Ce microbiote est constitué de milliards de microorganismes (bactéries, archées, virus et champignons) interagissant en continu entre eux, avec leur hôte mais aussi avec l’environnement.1,2 Par le biais de ces interactions, le MI exerce de nombreuses fonctions physiologiques (métaboliques, immunitaires, barrières …) à la fois au sein du tractus digestif mais également à distance de celui-ci. Par exemple, l’implication du MI dans la modulation du développement cérébral et dans la production de phénotypes comportementaux, initialement décrite dans la passionnante étude de Bercik et al. (2011)3, se retrouve actuellement sous les projecteurs dans le cadre de ce que l’on appelle “l’axe intestin-cerveau”. Les microorganismes du MI participent activement à cet axe d’interactions bidirectionnelles entre le système nerveux central (SNC) et l’intestin, par le biais de métabolites bactériens. Par exemple, le GABA ou la sérotonine produits par les bactéries du MI agissent sur le SNC directement après passage sanguin ou indirectement en stimulant les cellules entéro-endocrines ou les neurones intestinaux (~108 neurones tapissant la paroi intestinale).4,5 Ces nouvelles connaissances résonnent-elles in fine avec un concept chinois vieux de 5000 ans selon lequel notre ventre serait notre deuxième cerveau (Figure 1) ?

L’équilibre et la composition du MI vont être impactés tout au long de notre vie par divers facteurs intrinsèques (âge, infections, hormones …) ou environnementaux (alimentation, antibiotiques …).1,6 Or cet équilibre est indispensable aux nombreuses fonctions qu’il exerce, et sa perturbation, également appelée dysbiose, est de plus en plus décrite en association au développement ou à l’aggravation de certaines pathologies. Les données les plus évidentes concernent les maladies inflammatoires chroniques de l’intestin, l’obésité ou le cancer colorectal.2,7 De plus en plus d’études suggèrent également une implication du microbiote dans des pathologies d’ordre psychiatrique, en lien notamment avec le stress de l’hôte qui pourrait, via la libération dans le milieu intestinal de catécholamines et/ou de glucocorticoïdes, moduler directement (récepteurs adrénergiques bactériens) ou indirectement (modulation immunitaire, variation de pH …) les communautés bactériennes.5,8 Enfin, il a également été montré que le MI pouvait impacter la réponse à certaines thérapeutiques, comme cela a été montré pour les anticancéreux par les équipes de Laurence Zitvogel (Institut Gustave Roussy) et de François Ghiringhelli (INSERM – UMR123, Dijon).9
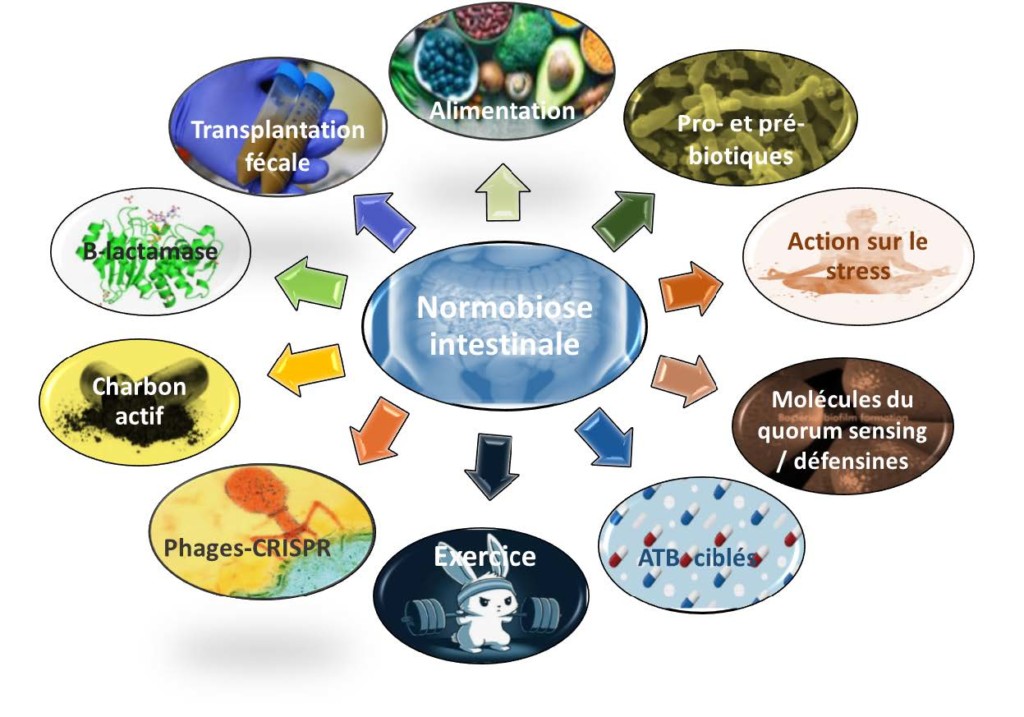
Bien que les mécanismes sous-jacents restent pour la plupart terra incognita, nous observons un engouement de la communauté scientifique pour les différentes voies de modulation du MI qui pourraient être proposées soit de façon préventive, soit comme option thérapeutique visant à rétablir l’équilibre intestinal, luttant ainsi contre les pathologies associées à une dysbiose (Figure 2).
Je suis ce que je mange : alimentation et homéostasie intestinale
L’alimentation, et plus particulièrement la diversité alimentaire, sont des éléments clé de la composition et de la stabilité du microbiote intestinal.10 Dès la naissance, le mode d’alimentation (allaitement vs. lait maternisé) va influencer l’implantation et la maturation du MI du nouveau-né. 1 Les grands types de régime alimentaire (riche en protéines, en fibres ou en lipides polyinsaturés) ont par ailleurs permis de stratifier des individus sains en fonction des microorganismes prédominants dans leur MI (Bacteroides, Prevotella ou Firmicutes), définissant ainsi des entérotypes.12-14 Cependant, cette stratification ne représente que le paysage global du MI et des modifications d’alimentation entraînent rapidement des variations fines de l’écosystème intestinal.6,15,16 Il semble ainsi intéressant de jouer sur l’alimentation de telle sorte à favoriser le développement et l’implantation de bactéries bénéfiques pour le système digestif. L’étude randomisée PREDIMEDA a en effet montré qu’un régime méditerranéenB réduisait de 30% le risque relatif d’accidents cardiovasculaires par le biais d’une modification du MI au profit d’une flore produisant plus d’acides gras à chaîne courte (AGCC)C .17 Il est également possible de moduler le MI à l’aide de compléments alimentaires tels que des prébiotiques utiles à la croissance ou l’activité de certaines populations bactériennes intestinales et dont nous reparlerons dans le chapitre suivant. Une autre voie, encore peu explorée, serait d’utiliser l’alimentation pour moduler l’environnement intestinal afin de favoriser ou inhiber certains taxons bactériens. Par exemple, une alimentation riche en lipides va augmenter la sécrétion de bile, orientant la flore vers des espèces résistantes à son action détergente telles que les Clostridia ou les Enterobacteriaceae.18 Il faut cependant noter que les modifications décrites dans la plupart des approches semblent temporaires, réversibles et plutôt difficile à maîtriser.15,18 Des études ont montré que la réponse de chaque individu à un type d’aliment variait, même chez des jumeaux homozygotes, et que l’on ne pouvait donc pas s’appuyer sur des recommandations nutritionnelles standard du type « 5 fruits et légumes par jour ».10,19 Il est donc possible d’envisager dans le futur une approche diététique personnalisée prenant en compte les interconnexions entre notre MI et le type d’aliments qui nous seraient bénéfiques. L’équipe d’Eran Elinav du Weizmann Institute en Israël a ainsi réussi à améliorer le contrôle de la glycémie de patients diabétiques par le biais de recommandations nutritionnelles individualisées basées sur l’analyse des interrelations entre l’alimentation, le taux sanguin de glucose et la composition du MI.16,20
Les p~biotiques (pro-, pré-, syn-, post- et parabiotiques) au service de notre MI
La seconde voie largement étudiée est celle de l’apport direct de bactéries bénéfiques (probiotiques) et/ou de substrats favorisant leur implantation (prébiotiques, synbiotiques), voire de biomolécules qui leur sont dérivées (post- et parabiotiques).
Les probiotiques sont définis en tant que microorganismes vivants qui, ingérés en quantité suffisante, exercent des effets bénéfiques à la santé de leur hôte.21 Les plus utilisés sont la levure Saccharomyces boulardii, certaines souches de Lactobacillus ou de Bifidobacterium ou la souche Escherichia coli Nissle 1917.4,22 Les principaux mécanismes expliquant leurs effets sont liés à des phénomènes 1) de nutrition (activité glycolytique menant à la production d’AGCC, principale source d’énergie des colonocytes), 2) de compétition (occupation des niches, utilisation des nutriments, production de peptides antimicrobiens) et 3) de renforcement de l’épithélium (modulation de l’immunité locale, stimulation de la production de mucus, préservation de l’intégrité de la barrière).22,23 Les prébiotiques sont quant à eux des oligo- ou polysaccharides alimentaires non digestiblesD qui stimulent de manière sélective la croissance, l’implantation ou l’activité de microorganismes bénéfiques dans le MI.11,24 Lorsqu’ils sont administrés simultanément à des probiotiques, on parle de synbiotiques. Enfin, l’amélioration des connaissances sur les mécanismes d’action des souches probiotiques a mené à l’émergence de nouveaux concepts s’éloignant de la notion de microorganismes vivants. Les postbiotiques correspondent aux métabolites sécrétés par les probiotiques et responsables de leurs effets bénéfiques tels que des AGCC, des vitamines, des peptides, des enzymes, …25 Le terme de parabiotiques fait référence aux probiotiques inactivés soit sous leur forme intacte, soit certaines fractions cellulaires (peptidoglycane, protéines de surfaces, extraits membranaires …).25
Le marché des p~biotiques étant colossal, un nombre impressionnant d’études portent sur l’évaluation de leur impact sur la composition du MI dans divers types de pathologies, présentant souvent des conclusions contradictoires, laissant les prescripteurs dans le doute. 11,22,26-28 Les seules indications faisant à l’heure actuelle l’objet de recommandations basées sur des essais randomisés +/- méta-analyses par des sociétés savantes sont les suivantes :
- Diarrhées infectieuses Lactobacillus rhamnosus GG et S. boulardii CNCM I-745 sont efficaces dans :
- la prévention des diarrhées associées aux antibiotiques chez l’enfant (recommandations ESPGHANE et GFHGNPF)
- le traitement de la gastroentérite aiguë de l’enfant en complément de la ré-hydratation (recommandations ESPGHANG)
- la prévention des diarrhées à Clostridioides difficile (recommandations Cochrane)26
- Syndrome de l’intestin irritable (SII) amélioration de la symptomatologie par :
- la formulation De SimoneH, les souches Bifidobacterium lactis DN-173010 et Bifidobacterium infantis 35624 (recommandations mondiales WGOI)
- seulement B. infantis 35624 (recommandations nationales SNFGEJ)
- Maladies inflammatoires chroniques de l’intestin (MICI) recommandations européennes de l’ECCOK :
- la formulation De Simone est efficace dans la prévention de la pochite et dans le maintien de la rémission de la pochite et de la rectocolite hémorragique (RCH)
- la souche Nissle 1917 présente la même efficacité que le mesalazine dans l’induction et le maintien de la rémission de la RCH
- aucune preuve de l’efficacité des p~biotiques dans la maladie de Crohn (MC)
De nombreuses autres souches candidates ont également été évaluées et semblent posséder des propriétés très intéressantes, mais l’hétérogénéité des résultats obtenus, avec parfois une contradiction totale, s’oppose pour l’instant à un consensus. Comment peut-on expliquer de telles discordances ? Cela pourrait provenir d’une part de la grande variabilité méthodologique : 1) microorganisme(s) utilisé(s) (bactérie ou levure, effet souche-dépendant très important, une espèce ou un consortium), 2) posologie et schéma d’administration (avant, après ou en même temps qu’une antibiothérapie), 3) profil des patients (nutrition parentérale, pathologie sous-jacente, traitements concomitants). D’autre part, l’état du MI du patient recevant les probiotiques pourrait également expliquer ces différences car il semblerait y avoir des individus dont le microbiote est permissif à l’implantation des probiotiques alors que d’autres possèderaient un microbiote résistant.29 Il en est de même pour l’action des prébiotiques dont l’effet bénéfique disparaît en l’absence de certains taxons bactériens spécialistes dans le MI.30
L’utilisation des synbiotiques semble une bonne alternative pour donner plus de chances aux probiotiques de coloniser l’intestin de l’individu qui les reçoit. Il a par exemple été montré dans une étude clinique réalisée en Inde rurale sur plus de 4500 nouveau-nés non prématurés, que l’administration simultanée de Lactobacillus plantarum et de FOSD pendant une semaine réduisait significativement la morbi-mortalité infectieuse jusqu’à 2 mois de vie.31 Sans mettre de côté les probiotiques traditionnels, les pistes de recherche s’orientent actuellement plutôt vers des espèces bactériennes provenant du MI plutôt que de l’alimentation, seules ou sous forme de consortia, possédant à la fois des activités métaboliques et immunomodulatrices. Plusieurs taxons ont déjà démontré leur intérêt en tant que probiotiques de nouvelle génération dont les principaux sont Faecalibacterium prausnitzii, Akkermansia muciniphila, Parabacteroides distasonis, plusieurs espèces de Bacteroides ou de Blautia.32-35
La transplantation de matière fécale : le retour de la soupe jaune
Alors qu’elle est connue et pratiquée en médecine traditionnelle chinoise depuis des centaines d’années, la transplantation de microbiote fécal (TMF) n’a fait son entrée dans nos pratiques cliniques que récemment.36 Elle est basée sur l’introduction des selles d’un donneur sain dans le tube digestif d’un patient receveur afin de rééquilibrer sa flore intestinale altérée. Elle permet donc de se départir du choix d’une ou plusieurs souches bénéfiques. Bien qu’au premier abord peu ragoutante, cette approche a démontré une remarquable efficacité dans le traitement des formes récidivantes d’infection à C. difficile (ICDr) avec un taux de guérison de 80 à 90%.36-39 C’est à l’heure actuelle la seule indication de la TMF règlementée, à la fois au niveau nationalL et international : traitement de l’ICDr à partir de la 3ème récidive. Cette indication pourrait évoluer suite à l’étude monocentrique randomisée de Hvas et al. (2019)40 démontrant la supériorité de la TMF sur la fidaxomicine et la vancomycine, antibiotiques indiqués en 1ère ligne pour le traitement de l’ICD.
De telles performances ont créé un rapide engouement vers les diverses applications envisageables de la TMF, engouement renforcé par une standardisation des pratiques, des simplifications méthodologiques (capsules), et des résultats positifs obtenus chez l’animal.37-39,41,42 De nombreux essais cliniques sont actuellement en cours dans des pathologies très variées telles que le SII, les troubles du spectre autistique, la maladie de Parkinson, la dépression, le portage de bactéries multirésistantes …38,42 Des résultats encourageants ont été obtenus par plusieurs équipes pour contrer la dysbiose des patients allogreffés de cellules souches hématopoïétiques présentant une GVHM digestive.43,44 En restaurant la diversité du MI, la TMF a ainsi permis d’obtenir une réponse clinique totale en 1 mois, sans autre intervention sur la GVH, chez 10 des 15 patients testés.43 Par ailleurs, bien que les résultats observés dans les MICI restent hétérogènes45, l’étude pilote, randomisée contrôlée, menée par Harry Sokol chez des patients atteints de MC, retrouve un taux plus important de rémission sans corticoïdes ainsi qu’une amélioration de l’inflammation dans le groupe TMF, malgré l’absence d’implantation du MI donneur.46 Ces résultats très prometteurs doivent être confirmés par des études de plus grande ampleur, et des résultats positifs à court terme ne doivent pas faire oublier les récentes découvertes quant aux nombreux rôles du MI en santé et pathologie ! En effet, même si la sécurité infectieuse du greffon fécal est bien explorée lors de la sélection du donneur, quand est-il des risques métaboliques ou cancérigènes que pourraient faire courir au receveur, à moyen ou long terme, la transplantation d’un contenu bactérien non caractérisé ? Il est donc indispensable de ne pas brûler les étapes et de s’appuyer sur un cadre scientifique documenté, standardisé et sécurisé, à nouveau dans le cadre d’une approche strictement personnalisée.
Autres approches de modulation du microbiote intestinal
Parmi les autres approches visant à moduler le MI, la pratique régulière du sport semble influencer l’écosystème intestinal. Ces modifications sont probablement le reflet d’un mode de vie « sain » en lien avec une alimentation plus équilibrée et moins de surpoids. Cependant des arguments en faveur d’un effet indépendant de l’exercice physique sur le MI ont aussi été démontrés. Par exemple, le MI de marathoniens contient plus de Veillonella spp. or l’administration de ce taxon à des souris améliore leur endurance en transformant le lactacte induit par l’exercice en propionate.47
Il a parfois été envisagé d’utiliser des antibiotiques ciblant des pathobiontes impliqués dans la physiopathologie de certaines maladies en se basant sur des observations comme par exemple l’amélioration de symptômes dépressifs ou psychiatriques sous antibiotiques.3,7 Cependant, une telle approche doit être envisagée avec beaucoup de prudence eu égard d’une part à la pression de sélection risquant d’entraîner l’émergence de bactéries multirésistantes et d’autre part à l’impact de l’antibiotique sur le MI pouvant induire une nouvelle dysbiose, voire de nouvelles pathologies associées.
Des approches de protection du MI contre la dysbiose induite par les antibiotiques sont également proposées sous la forme d’administration de β-lactamases ou de charbon activé dont la formulation leur permettrait de détruire ou d’adsorber spécifiquement les reliquats d’antibiotiques dans l’intestin.48,49
Afin de détruire spécifiquement des pathobiontes ou des bactéries multirésistantes au sein du MI, certaines équipes ont utilisé des bactériophages ou des souches de probiotiques génétiquement modifiées pour produire des molécules du qorum-sensing, des peptides antimicrobiens ou des systèmes CRISPR-Cas.50-53
Enfin, étant donné qu’un stress, même modéré, peut entraîner une dysbiose, il est aussi possible d’envisager l’utilisation des moyens actuels de lutte contre l’anxiété, pharmacologiques ou psychologiques, ainsi que l’utilisation de p~biotiques.54,55
En conclusion, le MI est donc en train de se positionner en tant que nouvelle cible thérapeutique dans la prise en charge personnalisée de différentes pathologies chroniques via des stratégies variées visant à restaurer son équilibre. Cependant, la manipulation d’un écosystème aussi complexe n’est pas sans risque. Il y a donc besoin de continuer l’exploration des mécanismes fondamentaux des interactions hôte/microbiote et de valider les observations par des études cliniques standardisées. Ces données, associées au développement d’outils de monitoring de la composition du MI applicables en routine, permettront de proposer des stratégies de modulation préventive ou curative adaptées à chaque patient.
Corentine Alauzet
EA 7300 Stress Immunité Pathogènes – Université de Lorraine
Service de Microbiologie – CHRU de Nancy
c.alauzet@chru-nancy.fr
Bibliographie :
-
Landman C, Quévrain E. Le microbiote intestinal: description, rôle et implications physiopathologiques. Rev Med Interne 2016;37:418–23.
-
Matijašić M, Meštrović T, Paljetak HČ, Perić M, Barešić A, Verbanac D. Gut Microbiota beyond Bacteria-Mycobiome, Virome, Archaeome, and Eukaryotic Parasites in IBD. Int J Mol Sci. 2020;21(8):2668.
-
Bercik P, Denou E, Collins J, Jackson W, Lu J, Jury J et al. The intestinal microbiota affects central levels of brain-derived neurotropic factor and behavior in mice. Gastroenterology. 2011;141(2):599-609.
-
Kelly JR, Kennedy PJ, Cryan JF, Dinan TG, Clarke G, Hyland NP. Breaking down the barriers: the gut microbiome, intestinal permeability and stress-related psychiatric disorders. Front Cell Neurosci 2015;9:392.
-
Silva YP, Bernardi A, Frozza RL. The Role of Short-Chain Fatty Acids From Gut Microbiota in Gut-Brain Communication. Front Endocrinol (Lausanne). 2020;11:25.
-
Doré J, Multon M-C, Béhier J-M. The human gut microbiome as source of innovation for health: Which physiological and therapeutic outcomes could we expect? Therapies. 2017;72(1):1-19.
-
Alauzet C. Microbiote intestinal, dysbiose et pathologies. Correspondances en Onco-Hématologie. 2017;13(3):119-124.
-
Alauzet C, Cunat L, Wack M, Lozniewski A, Busby H, Agrinier N et al. Hypergravity disrupts murine intestinal microbiota. Sci Rep. 2019;9(1):9410.
-
Viaud S, Saccheri F, Mignot G, Yamazaki T, Daillère R, Hannani D et al. The intestinal microbiota modulates the anticancer immune effects of cyclophosphamide. Science. 2013;342(6161):971-6.
-
Johnson AJ, Vangay P, Al-Ghalith GA, Hillmann BM, Ward TL, Shields-Cutler RR et al. Daily Sampling Reveals Personalized Diet-Microbiome Associations in Humans. Cell Host Microbe. 2019;25(6):789-802.e5.
-
Moszak M, Szulińska M, Bogdański P. You Are What You Eat-The Relationship between Diet, Microbiota, and Metabolic Disorders-A Review. Nutrients. 2020;12(4):1096.
-
Arumugam M, Raes J, Pelletier E, Le Paslier D, Yamada T, Mende DR et al. Enterotypes of the human gut microbiome.Nature. 2011 473(7346):174-80.
-
Wu GD, Chen J, Hoffmann C, Bittinger K, Chen YY, Keilbaugh SAet al. Linking long-term dietary patterns with gut microbial enterotypes. Science. 2011 334(6052):105-8.
-
Costea PI, Hildebrand F, Arumugam M, Bäckhed F, Blaser MJ, Bushman FD et al. Enterotypes in the landscape of gut microbial community composition. Nat Microbiol. 2018 3(1):8-16.
-
Leeming ER, Johnson AJ, Spector TD, Le Roy CI. Effect of Diet on the Gut Microbiota: Rethinking Intervention Duration. Nutrients. 2019;11(12):2862.
-
Leshem A, Segal E, Elinav E. The Gut Microbiome and Individual-Specific Responses to Diet. mSystems. 2020;5(5):e00665-20.
-
Estruch R, Ros E, Salas-Salvadó J, Covas MI, Corella D, Arós F et al. Primary Prevention of Cardiovascular Disease with a Mediterranean Diet Supplemented with Extra-Virgin Olive Oil or Nuts. N Engl J Med 2018; 378:e34.
-
Moles L, Otaegui D. The Impact of Diet on Microbiota Evolution and Human Health. Is Diet an Adequate Tool for Microbiota Modulation? Nutrients. 2020;12(6):1654.
-
Bowyer RCE, Jackson MA, Pallister T, Skinner J, Spector TD, Welch AA, Steves CJ. Use of dietary indices to control for diet in human gut microbiota studies. Microbiome. 2018;6(1):77.
-
Zeevi D, Korem T, Zmora N, Israeli D, Rothschild D, Weinberger A, et al. Personalized nutrition by prediction of glycemic responses. Cell 2015;163(5):1079-94
-
FAO/WHO (Food and Agricultural Organization of the United Nations and World Health Organization). Guidelines for the Evaluation of Probiotics in Food. Joint FAO/WHO Working Group Report on Drafting Guidelines for the Evaluation of Probiotics in Food. London Ontario (CA); 30 April and 1 May 2002. https://www.who.int/foodsafety/fs_management/en/probiotic_guidelines.pdf
-
Mekonnen SA, Merenstein D, Fraser CM, Marco ML. Molecular mechanisms of probiotic prevention of antibiotic-associated diarrhea. Curr Opin Biotechnol. 2020;61:226-234.
-
Butel M-J. Les probiotiques et leur place en médecine humaine. Journal des Anti-infectieux. 2014;16(2):33-43,
-
Gibson GR, Hutkins R, Sanders ME, Prescott SL, Reimer RA, Salminen SJ et al. Expert consensus document: The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics. Nat Rev Gastroenterol Hepatol. 2017;14(8):491-502.
-
Nataraj BH, Ali SA, Behare PV, Yadav H. Postbiotics-parabiotics: the new horizons in microbial biotherapy and functional foods. Microb Cell Fact. 2020;19(1):168.
-
Goldenberg JZ, Yap C, Lytvyn L, Lo CKF, Beardsley J, Mertz D, Johnston BC. Probiotics for the prevention of Clostridium difficile‐associated diarrhea in adults and children. Cochrane Database of Systematic Reviews 2017;12:CD006095.
-
Guo Q, Goldenberg JZ, Humphrey C, El Dib R, Johnston BC. Probiotics for the prevention of pediatric antibiotic-associated diarrhea. Cochrane Database of Systematic Reviews 2019;4:CD004827
-
Hori T, Matsuda K, Oishi K. Probiotics: A Dietary Factor to Modulate the Gut Microbiome, Host Immune System, and Gut-Brain Interaction. Microorganisms. 2020;8(9):E1401.
-
Zmora N, Zilberman-Schapira G, Suez J, Mor U, Dori-Bachash M, Bashiardes S et al. Personalized Gut Mucosal Colonization Resistance to Empiric Probiotics Is Associated with Unique Host and Microbiome Features. Cell. 2018;174(6):1388-1405.e21.
-
Chung WS, Walker AW, Louis P, Parkhill J, Vermeiren J, Bosscher D et al. Modulation of the human gut microbiota by dietary fibres occurs at the species level. BMC Biol 2016;14:3
-
Panigrahi P, Parida S, Nanda NC, Satpathy R, Pradhan L, Chandel DS et al. A randomized synbiotic trial to prevent sepsis among infants in rural India. Nature 548, 407–412 (2017).
-
O’Toole PW, Marchesi JR, Hill C. Next-generation probiotics: the spectrum from probiotics to live biotherapeutics. Nat Microbiol. 2017;2:17057.
-
Martín R, Miquel S, Benevides L, Bridonneau C, Robert V, Hudault S et al. Functional Characterization of Novel Faecalibacterium prausnitzii Strains Isolated from Healthy Volunteers: A Step Forward in the Use of F. prausnitzii as a Next-Generation Probiotic. Front Microbiol. 2017;8:1226.
-
Hiippala K, Kainulainen V, Suutarinen M, Heini T, Bowers JR, Jasso-Selles D et al. Isolation of Anti-Inflammatory and Epithelium Reinforcing Bacteroides and Parabacteroides Spp. from A Healthy Fecal Donor. Nutrients. 2020;12(4):935.
-
Bircher L, Geirnaert A, Hammes F, Lacroix C, Schwab C. Effect of cryopreservation and lyophilization on viability and growth of strict anaerobic human gut microbes. Microb Biotechnol. 2018;11(4):721-733. doi:10.1111/1751-7915.13265
-
Mosca A. La transplantation de microbiote fécal. La Revue des Microbiotes. 2019;13:4-11.
-
Cammarota G, Ianiro G, Tilg H, Rajilić-Stojanović M, Kump P, Satokari R et al. European consensus conference on faecal microbiota transplantation in clinical practice. Gut. 2017;66(4):569-580.
-
Quigley EMM, Gajula P. Recent advances in modulating the microbiome. F1000Res. 2020;9:F1000 Faculty Rev-46.
-
Trang C, Scanzi J, Galperine T, Mosca A, Batista R, Sokol H. Transplantation de microbiote fécal dans le cadre des infections à Clostridium difficile récidivantes : actualisation des recommandations pour la pratique clinique courante. Hépato-Gastro & Oncologie Digestive. 2017;24(4):319-325.
-
Hvas CL, Dahl Jørgensen SM, Jørgensen SP, Storgaard M, Lemming L, Hansen MM et al. Fecal Microbiota Transplantation Is Superior to Fidaxomicin for Treatment of Recurrent Clostridium difficile Infection. Gastroenterology. 2019;156(5):1324-1332.e3.
-
Cammarota G, Ianiro G, Kelly CR, Mullish BH, Allegretti JR, Kassam Z et al. International consensus conference on stool banking for faecal microbiota transplantation in clinical practice. Gut. 2019;68(12):2111-2121.
-
Gupta A, Saha S, Khanna S. Therapies to modulate gut microbiota: Past, present and future. World J Gastroenterol. 2020;26(8):777-788.
-
van Lier YF, Davids M, Haverkate NJE, de Groot PF, Donker ML, Meijer E et al. Donor fecal microbiota transplantation ameliorates intestinal graft-versus-host disease in allogeneic hematopoietic cell transplant recipients. Sci Transl Med. 2020;12(556):eaaz8926.
-
Zama D, Bossù G, Leardini D, Muratore E, Biagi E, Prete A et al. Insights into the role of intestinal microbiota in hematopoietic stem-cell transplantation. Ther Adv Hematol. 2020;11:1-19.
-
Xu D, Chen VL, Steiner CA, Berinstein JA, Eswaran S, Waljee AK et al. Efficacy of Fecal Microbiota Transplantation in Irritable Bowel Syndrome: A Systematic Review and Meta-Analysis. Am J Gastroenterol. 2019;114(7):1043-1050.
-
Sokol H, Landman C, Seksik P, Berard L, Montil M, Nion-Larmurier I et al. Fecal microbiota transplantation to maintain remission in Crohn’s disease: a pilot randomized controlled study. Microbiome. 2020;8(1):12.
-
Scheiman J, Luber JM, Chavkin TA, MacDonald T, Tung A, Pham LD et al. Meta-omics analysis of elite athletes identifies a performance-enhancing microbe that functions via lactate metabolism. Nat Med. 2019;25(7):1104-1109.
-
Kokai-Kun JF, Le C, Trout K, Cope JL, Ajami NJ, Degar AJ, Connelly S. Ribaxamase, an Orally Administered β-Lactamase, Diminishes Changes to Acquired Antimicrobial Resistance of the Gut Resistome in Patients Treated with Ceftriaxone. Infect Drug Resist. 2020;13:2521-2535.
-
de Gunzburg J, Ghozlane A, Ducher A, Le Chatelier E, Duval X, Ruppé E et al. Protection of the Human Gut Microbiome From Antibiotics. J Infect Dis. 2018;217(4):628-636.
-
Dong X, Pan P, Zheng DW, Bao P, Zeng X, Zhang XZ. Bioinorganic hybrid bacteriophage for modulation of intestinal microbiota to remodel tumor-immune microenvironment against colorectal cancer. Sci Adv. 2020;6(20):eaba1590.
-
Ramachandran G, Bikard D. Editing the microbiome the CRISPR way. Philos Trans R Soc Lond B Biol Sci. 2019;374(1772):20180103.
-
Saeidi N, Wong CK, Lo TM, Nguyen HX, Ling H, Leong SS et al. Engineering microbes to sense and eradicate Pseudomonas aeruginosa, a human pathogen. Mol Syst Biol. 2011;7:521.
-
Thompson JA, Oliveira RA, Djukovic A, Ubeda C, Xavier KB. Manipulation of the quorum sensing signal AI-2 affects the antibiotic-treated gut microbiota. Cell Rep. 2015;10(11):1861-71.
-
Burokas A, Arboleya S, Moloney RD, Peterson VL, Murphy K, Clarke G et al. Targeting the Microbiota-Gut-Brain Axis: Prebiotics Have Anxiolytic and Antidepressant-like Effects and Reverse the Impact of Chronic Stress in Mice. Biol Psychiatry. 2017;82(7):472-487.
-
Yu J, Wells J, Wei Z, Fewtrell M. Effects of relaxation therapy on maternal psychological state, infant growth and gut microbiome: protocol for a randomised controlled trial investigating mother-infant signaling during lactation following late preterm and early term delivery. Int Breastfeed J. 2019;14:50.
-
Nguyen N, Zhang B, Holubar SD, Pardi DS, Singh S. Treatment and prevention of pouchitis after ileal pouch-anal anastomosis for chronic ulcerative colitis. Cochrane Database Syst Rev. 2019;5(5):CD001176.
Notes: