Novembre 2020
Lichtheimia corymbifera
REGNE : Fungi
PHYLUM : Mucoromycota
ORDRE : Mucorales
FAMILLE : Lichtheimiaceae
L’ordre des Mucorales comprend 55 genres et 261 espèces dont 38 sont impliquées en pathologie humaine (1). Ces espèces thermophiles sont responsables d’infections opportunistes angio-invasives graves chez l’immunodéprimé avec des atteintes cutanées, pulmonaires, neuro-méningées, voire disséminées. La prise en charge thérapeutique repose sur la chirurgie, associée à l’amphotéricine B liposomale, puis un relais per os par posaconazole. Les Mucorales se caractérisent par une croissance rapide et extensive, et surtout par un développement aérien très important ; de plus, elles présentent à l’examen microscopique un thalle coenocytique constitué de filaments larges, irréguliers, et peu ou pas septés.
Spécificité du genre Lichtheimia
Le genre Lichtheimia (autrefois inclus dans le genre Absidia) a fait l’objet de changements taxonomiques depuis 2009 (1, 2). Auparavant, Lichtheimia corymbifera (autrefois Absidia corymbifera) était la seule espèce dans le genre Lichtheimia. Maintenant, d’autres espèces pathogènes sont décrites au côté de L. corymbifera, comme L. ramosa et L. ornata.
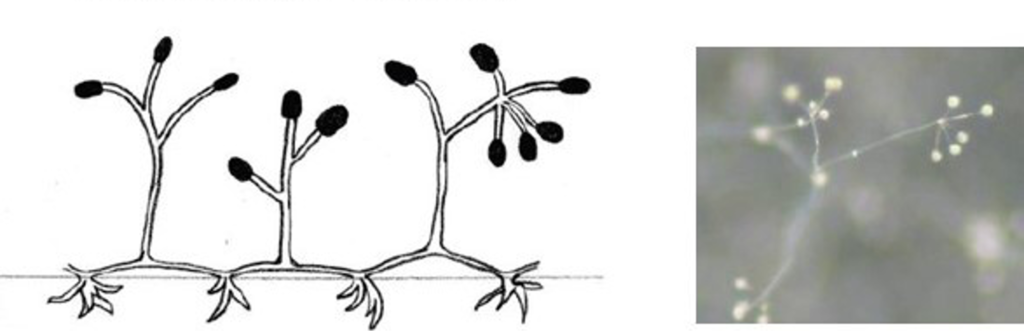
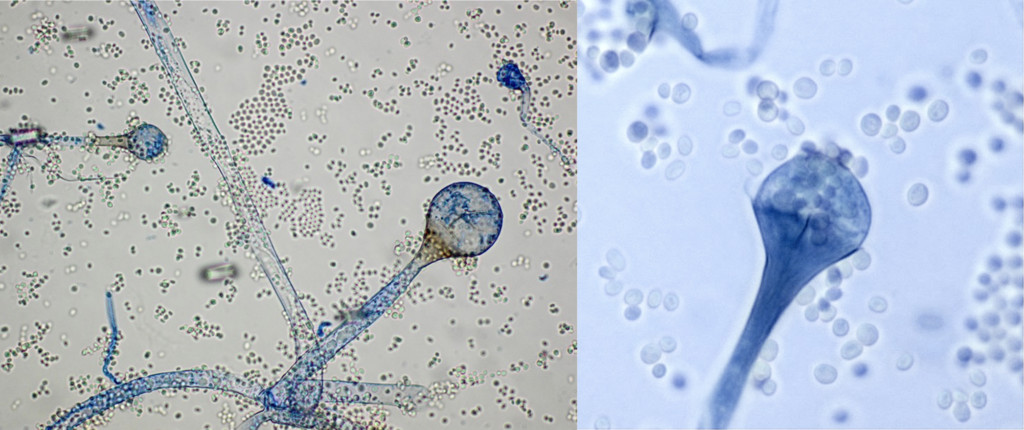
A l’examen microscopique, le genre Lichtheimia se caractérise par (Figures 1 et 2) :
- la disposition des sporocystophores isolés ou groupés, insérés sur les stolons, ramifiés en grappe ;
- l’évasement en entonnoir du sporocystophore à son extrémité, dessinant une large apophyse conique ;
- l’aspect piriforme des sporocystes avec une columelle hémisphérique faisant saillie dans le sporocyste ;
- et la présence de rhizoïdes, généralement peu nombreux et situés sur les stolons, à distance des nœuds (points d’insertion des sporocystophores sur les stolons).
L’identification du genre Lichtheimia et de ses principales espèces (L. corymbifera, L. ramosa, L. ornata) peut être réalisée à partir de colonies en culture, par des techniques de PCR ciblant différentes régions des ADN ribosomaux (18S, 28S, ou les régions ITS pour Internal transcribed spacer), ou par spectrométrie de masse de type MALDI-TOF (3, 4). L’identification peut être réalisée également directement sur des biopsies (pulmonaires, ORL, cutanées, …) grâce à une PCR spécifique de genre, ou par une PCR panfongique suivis d’un séquençage. La détection du genre Lichtheimia, ainsi que des autres Mucorales les plus fréquemment responsables de mucormycose, peut être réalisée également à partir d’un prélèvement sanguin (sérum ou plasma) ou de prélèvements respiratoires (liquide de lavage broncho alvéolaire) par PCR quantitative en temps réel. La détection d’ADN circulant par PCR quantitative permet une précocité diagnostique estimée à 9 jours (5).
A côté de véritables mycoses, les moisissures du genre Lichtheimia sont également impliquées comme agents étiologiques de pathologies respiratoires chroniques, les pneumopathies d’hypersensibilité (PHS), en particulier dans la forme agricole appelée Poumon de Fermier (PDF). Concernant le PDF, des actinomycètes comme Saccharopolyspora rectivirgula sont reconnus comme agent étiologique de cette maladie depuis les années 70, mais cette pneumopathie d’hypersensibilité peut également être déterminée par des moisissures, notamment L. corymbifera. Lichtheimia corymbifera est fréquemment isolé du foin moisi et des taux élevés d’anticorps spécifiques précipitants peuvent être détectés dans le sérum des travailleurs agricoles atteints de PDF (6) ; une étude in vitro sur lignée de cellules épithéliales pulmonaires a par ailleurs montré que L. corymbifera induisait une réponse inflammatoire aussi forte que celle induite par S. rectivirgula, renforçant l’hypothèse d’un rôle étiologique important de L. corymbifera dans le PDF (7) ; enfin, l’existence de séquences d’acides aminés communes entre des protéines orthologues de L. corymbifera et de Mycobacterium immunogenum (principal agent étiologique du Poumon de mécanicien) a été démontrée (8). Ces épitopes communs entre des protéines antigéniques de microorganismes de familles phylogénétiquement très éloignées, tous deux responsables du même type de maladie immunologique, ouvrent de voies nouvelles pour le développement de stratégies diagnostiques et thérapeutiques innovantes dans le domaine des PHS.
Pour plus d’informations, consulter :
- Walther G, Wagner L, Kurzai O. Updates on the taxonomy of Mucorales with an emphasis on clinically important taxa. J Fungi (Basel). 2019;5(4):106.
- Garcia-Hermoso D, Hoinard D, Gantier JC, Grenouillet F, Dromer F, Dannaoui E. Molecular and phenotypic evaluation of Lichtheimia corymbifera (formerly Absidia corymbifera) complex isolates associated with human mucormycosis: rehabilitation of L. ramosa. J Clin Microbiol. 2009;47(12):3862-3870.
- Dannaoui, E. Molecular tools for identification of zygomycetes and the diagnosis of zygomycosis. Clin Microbiol Infect. 2009;15:66-70.
- Shao J, Wan Z, Li R, Yu J. Species identification and delineation of pathogenic Mucorales by matrix-assisted laser desorption ionization-time of flight mass spectrometry. J Clin Microbiol. 2018;56(4):e01886-17.
- Millon L, Scherer E, Rocchi S, Bellanger AP. Molecular strategies to diagnose mucormycosis. J Fungi (Basel). 2019;5(1):24.
- Roussel S, Reboux G, Dalphin JC, Pernet D, Laplante JJ, Millon L, Piarroux R. Farmer’s lung disease and microbiological composition of hay: a case-control study. Mycopathologia. 2005;160(4):273-279.
- Bellanger AP, Reboux G, Botterel F, Candido C, Roussel S, Rognon B, Dalphin JC, Bretagne S, Millon L. New evidence of the involvement of Lichtheimia corymbifera in farmer’s lung disease. Med Mycol. 2010;48(7):981-987.
- Millon L, Rognon B, Valot B, Barrera C, Bellanger AP, Roussel S, Dalphin JC, Monod M, Reboux G. Common peptide epitopes induce cross-reactivity in hypersensitivity pneumonitis serodiagnosis. J Allergy Clin Immunol. 2016;138(6):1738-1741.
Anne Pauline Bellanger et Laurence Millon
(Laboratoire de Parasitologie-Mycologie – CHU Besançon, UMR ChronoEnvironnement CNRS 6249 – Université de Bourgogne Franche-Comté)