La substitution des molécules “plateformes” pétro-sourcées par des équivalents bio-sourcés est un des principaux défis à relever pour contribuer à une bioéconomie durable. Les acides organiques et, en particulier, les acides organiques polyfonctionnels, représentent des cibles significatives en termes de marchés. En particulier, l’acide 3-hydroxypropionique (3-HP) (OH-CH2-CH2-COOH) avec ses deux fonctions hydroxyle et acide, fait partie des cibles de fort intérêt technologique pour la production de molécules comme l’acide acrylique, l’acrylamide et leurs polymères… utilisés ensuite dans des produits d’usages (résines, latex, textiles, peintures…).
L’équipe ProBioSSep de l’UMR SAYFOOD AgroParisTech-INRAE travaille sur la production de 3-HP par un procédé couplant deux microorganismes, auquel est intégré un procédé d’extraction liquide-liquide réactive en ligne.
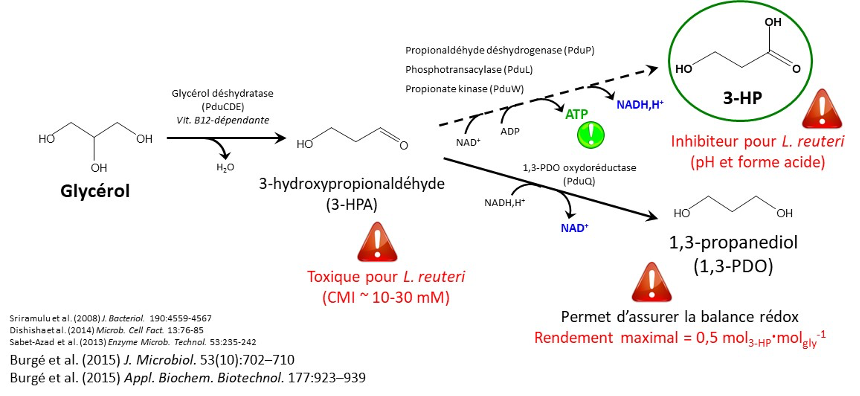
Lactobacillus reuteri (souche DSM 17 938) est une bactérie naturellement productrice de 3-HP : elle réalise la bioconversion du glycérol en 3-HP et 1,3 PDO (figure 1). Cependant, trois problèmes doivent être levés : l’intermédiaire métabolique 3-HPA est très toxique pour les cellules, le 3-HP est également toxique pour les bactéries, et la production de 1,3-PDO est obligatoire pour assurer la balance redox, mais réduit le rendement de 50%.
Le premier verrou a été levé en apportant progressivement le glycérol aux bactéries. En effet, alors qu’un apport initial de tout le glycérol dans le bioréacteur conduit à une mort cellulaire après 1 h de bioconversion (forte accumulation de 3-HPA et pas de production de 3-HP), l’alimentation progressive a permis une bioconversion pendant 58 h avec production de 12 g/L de 3-HP, 10 g/L de 1,3-PDO et encore 64 % de cellules viables en fin de procédé (évaluées par un marquage simultané au cFDA et à l’IP, détecté par cytométrie en flux).
Pour lever le 2ème verrou d’inhibition de la bactérie par le produit, une extraction liquide-liquide réactive a été mise en place simultanément à la bioconversion. Le milieu de bioconversion, contenant les cellules, circule en continu du bioréacteur dans un contacteur membranaire. Au sein de ce contacteur circule une phase organique extractante, composée d’amines diluées dans un solvant, qui permet de récupérer sélectivement l’acide organique. Les stress causés par l’extraction, notamment celui dû à la circulation des bactéries dans le contacteur membranaire d’une part, et celui dû au solvant, d’autre part, ont été évalués par cytométrie en flux. Le premier stress est négligeable mais le choix du solvant, pour maintenir un état cellulaire actif des bactéries, est déterminant. Un mélange de solvant minimisant l’effet sur l’activité des bactéries a été sélectionné puis mis en œuvre.
Enfin, pour augmenter le rendement global de conversion du glycérol en 3-HP, la solution mise en œuvre par les chercheurs a été d’utiliser une deuxième bactérie, Acetobacter sp. CIP 58.66, capable d’oxyder le 1,3-PDO en 3-HP. Après une phase de croissance aérobie, la biomasse d’Acetobacter maintenue en forte aérobiose est alimentée en 1,3-PDO : une concentration de 70 g/L de 3-HP a été obtenue avec un rendement de 1 mole3-HP/mole1,3-PDO et une productivité supérieure à 1 g3-HP.L-1.h-1.
De manière à récupérer sélectivement le 3-HP, une extraction liquide-liquide réactive en contacteur membranaire a été couplée à la bioconversion, suivie d’une récupération en phase aqueuse grâce à un second contacteur. Ce procédé intégré de bioconversion extractive a permis de récupérer la totalité du 3-HP produit par les bactéries sans contrôle du pH lors de la bioconversion.
Ces travaux sont poursuivis pour intégrer l’ensemble du procédé, comprenant les productions de biomasse de L. reuteri et d’Acetobacter, la production de 3-HP et 1,3-PDO par bioconversion du glycérol avec L. reuteri, puis la bioconversion du 1,3-PDO en 3-HP par Acetobacter, et l’extraction du 3-HP en continu. Des productions d’autres acides organiques d’intérêt sont en cours d’étude pour une généralisation de ce procédé intégré.
Références bibliographiques :
- Brevet n° EP20305396.2, déposé le 22/04/2020. Spinnler H.E., de Fouchécour F., Sánchez-Castañeda A.K., Trelea C., Athès V., Saulou-Bérion C., Moussa M.. Production par Acetobacter sp. d’acide 3-hydroxypropionique et extraction en ligne par un contacteur membranaire.
- Burgé G., Saulou-Bérion C., Moussa M., Pollet B., Flourat A., Allais F., Athès V., Spinnler H.E. (2015). Diversity of Lactobacillus reuteri strains in converting glycerol into 3-hydroxypropionic acid. Applied Biochemistry and Biotechnology, 177 (4), 923-939.
- Burgé G., Chemarin F., Moussa M., Saulou-Bérion C., Allais F., Spinnler H.E., Athès V. (2016). Reactive extraction of bio-based 3-hydroxypropionic acid assisted by hollow-fiber membrane contactor using TOA and Aliquat 336 in n-decanol. Journal of Chemical Technology and Biotechnology, 91 (10), 2705-2712.
- Burgé G., Moussa M., Saulou-Bérion C., Chemarin F., Kniest M., Allais F., Spinnler H.E., Athès V. (2017). Towards an extractive bioconversion of 3-hydroxypropionic acid: study of inhibition phenomena. Journal of Chemical Technology and Biotechnology, 92 (9), 2425-2432.
- de Fouchécour F., Sánchez-Castañeda A.K., Saulou-Bérion C., Spinnler H.E. (2018). Process engineering for microbial production of 3-hydroxypropionic acid. Biotechnology Advances, 36(4), 1207-1222.
- Sánchez-Castañeda A.K., Moussa M., Ngansop L., Trelea I.C., Athès V. (2020). Organic phase screening for in‐stream reactive extraction of bio‐based 3‐hydroxypropionic acid: biocompatibility and extraction performances. Journal of Chemical Technology and Biotechnology, 95(4), 1046–1056.
Pour en savoir plus, contacter : Claire SAULOU-BERION (claire.saulou@agroparistech.fr)