Janvier 2021
Exophiala jeanselmei
REGNE : Fungi
PHYLUM : Dikarya, Ascomycota
CLASSE : Eurotiomycètes
ORDRE : Chaetothyriales
FAMILLE : Herpotrichiellaceae
Les espèces du genre Exophiala sont des dématiés, c’est-à-dire des champignons filamenteux producteurs de mélanine, conférant à la paroi une pigmentation qui tend vers le brun foncé-noir. Elles sont de distribution large, et sont retrouvées dans les environnements communs et souvent associées au bois en décomposition ou au sol enrichi en déchets organiques.
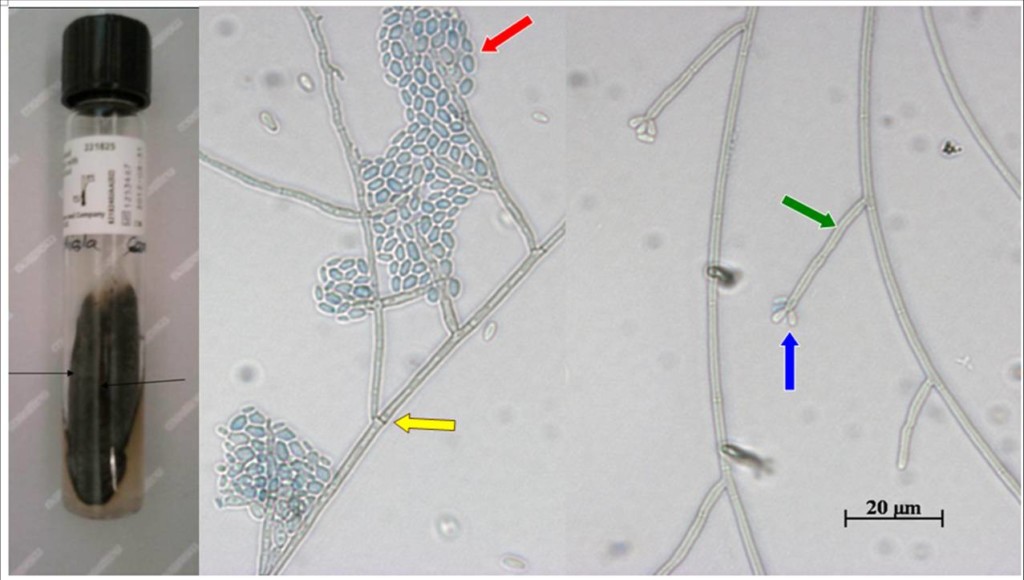
L’espèce Exophiala jeanselmei comprend quatre variants différents : E. jeanselmei var. heteromorpha, E. jeanselmei var. lecanii-corni, E. jeanselmei var. jeanselmei et E. jeanselmei var. castellanii (1). La croissance in vitro d’Exophiala jeanselmei est lente. Au recto, les colonies sont initialement lisses, gris verdâtre à noires, d’allure mucoïde et ressemblent à des colonies de levures foncées. Par la suite, elles se recouvrent de mycélium aérien qui forme un dôme duveteux (Figure 1). Le revers apparaît sombre, de couleur noire à olivacée. Le champignon pousse jusqu’à 37°C, mais pas à des températures supérieures ou égales à 40°C. À l’examen microscopique, de nombreuses cellules bourgeonnantes ellipsoïdales ressemblant à des levures sont généralement présentes, en particulier dans les cultures jeunes. Dispersées parmi ces éléments lévuriformes, se trouvent des cellules plus grosses, rondes ou ellipsoïdales. Elles sont issues de la transformation des filaments mycéliens, initialement cloisonnés et de diamètre fin et régulier, et qui progressivement se vésiculisent et se fragmentent avec production de courts filaments toruloïdes, dont les cellules ellipsoïdes se dissocient progressivement. Les filaments mycéliens, initialement brun clair, deviennent finalement bien foncés et ne portent pas de conidiophore multicellulaire. Les cellules conidiogènes apparaissent à l’extrémité des filaments mycéliens, ou sur leurs côtés ; elles sont alors insérées à angle droit. Ce sont de petites annélides cylindriques à extrémité effilée, mesurant 1 – 3 µm de long (Figure 1). A leur maturité, elles sont en forme de fusée, légèrement plus foncées que l’hyphe de soutien, avec, à leur apex, des zones annelées effilées qui apparaissent régulières. Les conidies produites sont unicellulaires (on parle alors d’amérospores), hyalines et lisses, à parois minces, ellipsoïdales, et mesurent en moyenne 3,8 x 1,7 µm ; leur cicatrice de libération est peu visible (Figure 1). Les conidies s’accumulent souvent au sommet des annélides, puis glissent le long de celles-ci. Exophiala oligosperma, E. nishimurae et E. xenobiotica sont des espèces très proches d’E. jeanselmei (1). Sans l’œil expérimenté du microscopiste ni le recours aux outils moléculaires, l’analyse morphologique est souvent insuffisante pour les distinguer les unes des autres (2,3). Le séquençage ADN des régions ITS (internal transribed spacers) ou du domaine D1/D2 de la grande sous-unité 28S de l’ARN ribosomal permet de proposer une identification formelle.
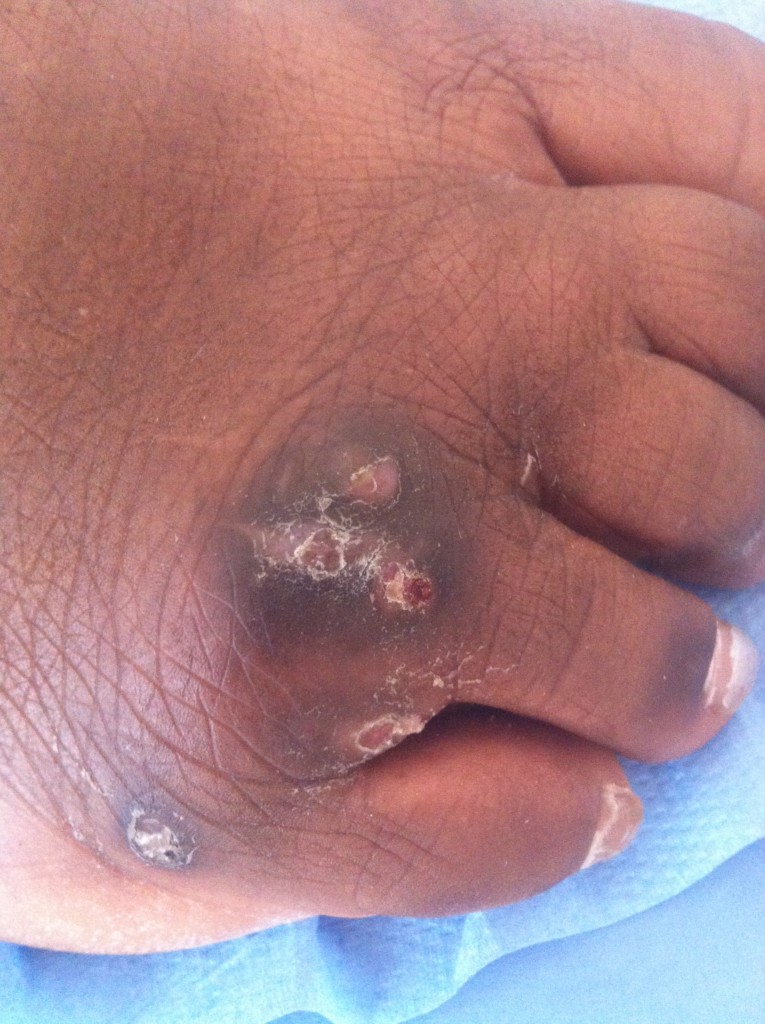
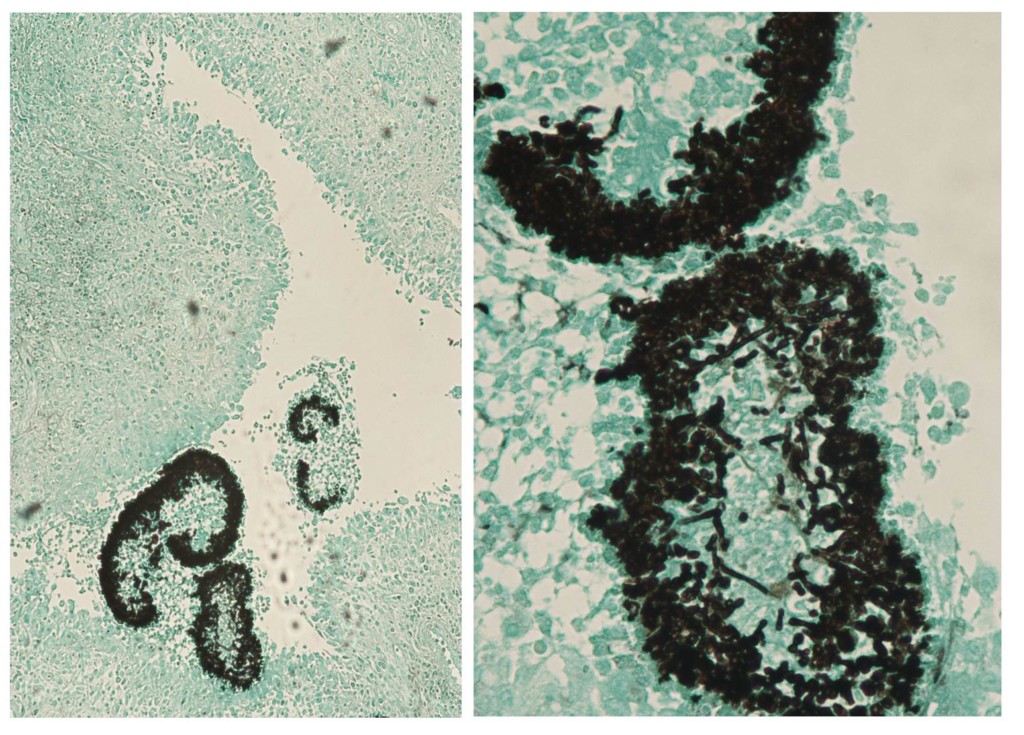
Exophiala jeanselmei est responsable de phaeohyphomycoses et de mycétomes (4), principalement dans la ceinture subsaharienne qui s’étale du Sénégal au Soudan, mais aussi en Inde (5,6). L’infection est majoritairement sous-cutanée. Elle résulte le plus souvent d’une implantation traumatique d’une épine ou d’une écharde qui sert de véhicule à l’organisme fongique. Le développement y est chronique et globalement asymptomatique au début du processus. En cas de phaeohyphomycose, le champignon se développe dans les tissus sous forme de filaments pigmentés libres. Un nodule ou un kyste finit par être visible, à l’œil nu ou à l’imagerie. Les mycétomes correspondent à la formation de grains fongiques, qui donnent plutôt des lésions bourgeonnantes et d’allure pseudo-tumorale des tissus mous (Figure 2), proche du point d’inoculation. Les grains caractéristiques des mycétomes peuvent sourdre de pertuis naturels ou être observés en laboratoire après biopsie (Figure 3). Des infections disséminées ont été rapportées chez des patients immunodéprimés, générant par exemple des endocardites ou des atteintes cérébrales. De très rares cas d’infections oculaires ou d’onychomycoses ont également été décrits chez des individus non immunodéprimés.
Les concentrations minimales inhibitrices (CMI) des antifongiques vis-à-vis d’Exophiala jeanselmei sont élevées pour le fluconazole et la flucytosine, et généralement basses pour l’itraconazole, le posaconazole et la terbinafine. Des succès thérapeutiques ont déjà été observés avec ces derniers, ainsi qu’avec l’amphotéricine B ou le voriconazole, mais le recours à la chirurgie reste la meilleure garantie pour assurer la guérison définitive.
Pour plus d’informations, consulter :
- Morio F, Berre J-YL, Garcia-Hermoso D, Najafzadeh MJ, de Hoog S, Benard L, et al. Phaeohyphomycosis due to Exophiala xenobiotica as a cause of fungal arthritis in an HIV-infected patient. Med Mycol. 2012;50(5):513–7.
- Desnos-Ollivier M, Bretagne S, Dromer F, Lortholary O, Dannaoui E. Molecular identification of black-grain mycetoma agents. J Clin Microbiol. 2006;44(10):3517–23.
- Chen Z, Martinez DA, Gujja S, Sykes SM, Zeng Q, Szaniszlo PJ, et al. Comparative genomic and transcriptomic analysis of wangiella dermatitidis, a major cause of phaeohyphomycosis and a model black yeast human pathogen. G3 (Bethesda). 2014;4(4):561–78.
- Zeng JS, Sutton DA, Fothergill AW, Rinaldi MG, Harrak MJ, de Hoog GS. Spectrum of clinically relevant Exophiala species in the United States. J Clin Microbiol. 2007;45(11):3713–20.
- Severo LC, Oliveira FM, Vettorato G, Londero AT. Mycetoma caused by Exophiala jeanselmei. Report of a case successfully treated with itraconazole and review of the literature. Rev Iberoam Micol. 1999;16(1):57–9.
- Capoor MR, Khanna G, Nair D, Hasan A, Rajni, Deb M, et al. Eumycetoma pedis due to Exophiala jeanselmei. Indian J Med Microbiol. 2007;25(2):155–7.
Guillaume Desoubeaux et Adélaïde Chesnay
(Laboratoire de Parasitologie-Mycologie, CHU de Tours)









