Décembre 2021
Diplocarpon rosae
REGNE : Eumycota (Fungi)
DIVISION : Ascomycota
SOUS-DIVISION : Pezizomycotina
CLASSE : Leotiomycetes
ORDRE : Helothales
FAMILLE : Drepanopezizaceae
GENRE : Diplocarpon

Une BD pour mieux comprendre la maladie des taches noires du rosier
https://www6.angers-nantes.inrae.fr/irhs/La-science-et-vous2/Mediation-scientifique/BD-tache-noire-rosier
Le genre Diplocarpon est un groupe de champignons phytopathogènes hémibiotrophes connus pour infecter les plantes de la famille des Rosaceae. Ainsi, Diplocarpon mali infecte le pommier et Diplocarpon fragariea le fraisier, alors que Diplocarpon rosae infecte le rosier sur lequel il provoque la maladie des taches noires (Gachomo et al., 2010).
La maladie des taches noires a été observée dès 1815 en Suède et le champignon responsable a pu être identifié sous sa forme sexuée (Diplocarpon rosae) et sous sa forme asexuée (Marssonnina rosae). D’autres synonymes du stade asexué sont aussi référencés tel que Asteroma rosae, Actinonema rosae, and Marsonia rosae (Baker, 1948 ; Horst, 1983).
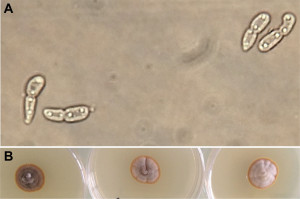
Diplocarpon rosae se caractérise par des spores bicellulaires (Figure 1A) et une grande variabilité macroscopique attestée par la grande diversité de taille et d’aspect des colonies obtenues pour différentes souches monosporées cultivées sur milieu malt-agar (Figure 1B). La croissance sur ce milieu est lente (plus de 15 jours pour obtenir un mycélium bien visible).
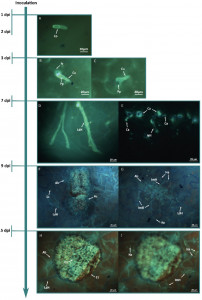
Dans les régions tempérées, l’infection démarre au printemps et touche uniquement les rosiers de jardin. Les spores de l’année précédente sont projetées sur les feuilles basales de la plante (phénomène de “splashing”), germent et pénètrent la cuticule des génotypes sensibles dans les 48 heures, puis des hyphes subcutilaires et intercellulaires se forment. Il faut compter entre 9 et 15 jours pour observer l’apparition des acervules qui permettront aux nouvelles conidies de coloniser les étages supérieurs de la plante, toujours grâce au phénomène de “splashing” (Figure 2). Ce champignon hémibiotrophe se caractérise par une phase biotrophe (association avec les cellules de l’hôte), puis nécrotrophe en entraînant la mort cellulaire. Les symptômes sur la plante hôte peuvent aller, selon la sensibilité des différents génotypes de rosiers, du “point noir” à une tache en forme de tache d’encre sur un buvard tel que présenté en Figure 3 (Soufflet-Freslon et al., 2019). La maladie se maintient de mai à septembre en fonction des conditions environnementales.

Il est rare que cette maladie provoque la mort de son hôte, mais ce champignon a un impact important sur l’aspect esthétique de son hôte. De ce fait, mais aussi en raison de l’interdiction des pesticides de synthèse dans les collectivités et jardins de particuliers (Loi Labbé 2017-2019), les obtenteurs ont fait un effort particulier pour obtenir des rosiers naturellement résistants à ce champignon. Plusieurs études ont permis de caractériser des gènes de résistance majeurs localisés dans des régions génomiques appelées Quantitative Trait Loci ou QTLs (Lopez-Arias et al., 2020).
La séquence de ce champignon a été obtenue en 2017 (Neu et al.) et plusieurs souches ont été séquencées permettant de développer des marqueurs microsatellites. Ces marqueurs ont été utilisés pour caractériser une collection de souches monosporées de Diplocarpon rosae issues de rosiers modernes et de rosiers sauvages, montrant ainsi une forte divergence entre ces deux groupes (Marolleau et al., 2020).
Pour plus d’informations, consulter :
- Baker K.F. The history, distribution and nomenclature of the rose black spot fungus. Plant Dis Rep. 1948;32:260-74.
- Debener T. The beast and the beauty: What do we know about black spot in roses? Crit Rev Plant Sci. 2019;38(4):313-26.
- Gachomo EW, Kotchoni SO. Microscopic and biochemical evidence of differentially virulent field isolates of Diplocarpon rosae causing black spot disease of roses. Plant Physiol Biochem. 2010;48(2-3):167-75.
- Horst RK. Black spot. In: Compendium of rose diseases. The American Phytopathological Society, APS Press, St. Paul, MN.1983:7-11.
- Labbé J. Loi n° 2014-110 du 6 février 2014 visant à mieux encadrer l’utilisation des produits phytosanitaires 824 sur le territoire national.
- Lopez Arias D, Chastellier A, Thouroude T, Bradeen J, van Eck L, de Oliveira Y, Paillard S, Foucher F, Hibrand-Saint Oyant L, Soufflet-Freslon V. Characterization of black spot resistance in diploid roses with QTL detection, meta-analysis and candidate-gene identification. Theor Appl Genet. 2020;133:3299-321.
- Neu E, Featherston J, Rees J, Debener T. A draft genome sequence of the rose black spot fungus Diplocarpon rosae reveals a high degree of genome duplication. PloS One. 2017;12(10).
- Marolleau B, Petiteau A, Bellanger MN, Sannier M, Le Pocreau N, Porcher L, Paillard S, Foucher F, Thouroude T, Serres-Giardi L, Aguileta G, Chastellier A, Bonneau C, Le Cam B, Soufflet-Freslon V, Hibrand-Saint Oyant L. Strong differentiation within Diplocarpon rosae strains based on microsatellite markers and greenhouse-based inoculation protocol on Rosa. Plant Pathol. 2020;69(6):1093-107.
- Soufflet-Freslon V, Marolleau B, Thouroude T, Chastellier A, Pierre S, Bellanger MN, Le Cam B, Bonneau C, Porcher L, Leclere A, Robert F, Felix F, Foucher F, Hibrand-Saint Oyant L. Development of tools to study rose resistance to black spot. Acta Horticulturae. 2019;1232:213-20.
Dr Laurence Hibrand-Saint Oyant
(Institut de Recherche en Horticulture et Semences (IRHS), Equipe GDO Génétique et Diversité des plantes ornementales, INRAE, Angers)









