Avril 2022
Arachnomyces nodosetosus
(anciennement Onychocola canadensis)
REGNE : Eumycota (Fungi)
DIVISION : Dikarya, Ascomycota
SOUS-DIVISION : Pezizomycotina
CLASSE : Eurotiomycetes
ORDRE : Onygenales
FAMILLE : Arachnomycetaceae
GENRE : Arachnomyces
Arachnomyces nodosetosus est un champignon filamenteux arthrosporé de découverte relativement récente. Décrit pour la première fois en 1990 au Canada au cours d’onychomycoses sous le nom d’Onychocola canadensis, il a ensuite été rapporté en Nouvelle-Zélande, puis en Europe. Ce champignon est essentiellement rencontré dans les régions tempérées ou froides, bien qu’il ait été signalé en Turquie et au Maroc. La source de contamination est inconnue, mais sa fréquence chez des jardiniers ou des individus vivant en milieu rural (agriculteurs, fermiers…) suggère une origine tellurique. Par ailleurs, Gibas et collaborateurs ont décrit en 2002 une autre espèce au sein du même genre, A. kanei, également capable d’engendrer des onychomycoses chez l’Homme.
Arachnomyces nodosetosus est une moisissure kératinophile non-dermatophytique (“pseudodermatophyte”) à l’origine d’onychomycoses des pieds, notamment de l’hallux, et plus rarement d’intertrigos interdigito-plantaires rapportés essentiellement chez des personnes âgées présentant des troubles vasculaires des membres inférieurs (lymphoedèmes, ulcères), associés ou non à un diabète mal équilibré.
L’infection évolue lentement et débute classiquement par le bord distal de l’ongle. Ce dernier prend habituellement une couleur blanc-jaunâtre, avec une atteinte le plus souvent sous-unguéale de type distolatérale, plus rarement superficielle (leuconychies). Parfois, aucune preuve d’atteinte unguéale ne peut être apportée (i.e., examen direct et/ou histologie négatifs), malgré un isolat correctement identifié. L’onychomycose à A. nodosetosus reste une entité rare avec moins d’une centaine de cas rapportés dans la littérature, mais son incidence est probablement sous-estimée.
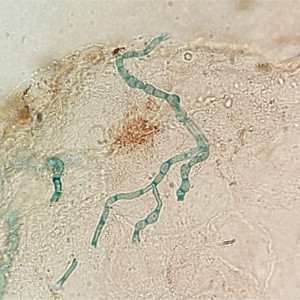
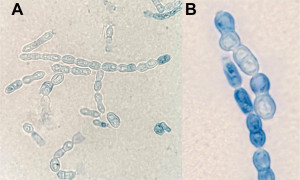
Le diagnostic biologique d’une onychomycose à A. nodosetosus est réputé difficile. L’examen direct après éclaircissement permet d’observer des filaments fins, septés et hyalins (Figure 1), parfois associés à des spores rondes ou en tonnelet. En culture, il présente une croissance très lente à 20-25°C, les colonies apparaissant au plus tôt 15 jours après l’ensemencement sur milieu de Sabouraud additionné ou non de cycloheximide. De petite taille, les colonies initialement blanchâtres, duveteuses et d’aspect neigeux (Figure 2A) s’incrustent progressivement dans la gélose (Figure 2B). En vieillissant, les colonies peuvent prendre une teinte brunâtre au recto, foncée au verso. Sur le plan microscopique, les cultures jeunes présentent des filaments fins, hyalins, sans fructification. Ce n’est que sur des cultures tardives (≥ 4 semaines) qu’apparaissent des chaînes d’arthrospores disposées à angle droit (Figure 3A). Celles-ci sont rondes à ovoïdes, avec parfois une cloison centrale (Figure 3B). En l’absence de sporulation, le séquençage des régions ITS des ADN ribosomaux peut être mis à profit pour l’identification. En revanche, la spectrométrie de masse MALDI-TOF ne permet pas d’identifier les champignons du genre Arachnomyces dont les spectres ne sont pas encore disponibles dans les bases de données en ligne.

Le diagnostic différentiel avec d’autres champignons arthrosporés tels que Neoscytalidium sp. ou Geotrichum sp. est aisé compte tenu de leur croissance rapide, de leur morphologie microscopique (spores d’aspect cylindrique) et de leur sensibilité au cycloheximide.
Le traitement des onychomycoses à A. nodosetosus n’est pas codifié et peu de données sont disponibles dans la littérature. En cas d’atteinte limitée distolatérale, un traitement par découpage ou avulsion chimique avec un kératinolytique (préparation à base d’urée à 40%, vaseline salicylée…) de la zone parasitée, suivi ou non d’une solution filmogène à base de ciclopiroxolamine ou amorolfine, peut être proposé. Quand l’atteinte est matricielle, le traitement local est souvent insuffisant. L’itraconazole et la terbinafine per os constituent des options intéressantes. En effet, ces antifongiques systémiques utilisés en thérapie intermittente (« pulse ») à raison d’une ou deux prise(s) par jour, une semaine par mois pendant 3 à 5 mois, ont été associés à des succès thérapeutiques. Pour autant, le suivi à long-terme n’est pas toujours disponible, ce qui ne permet pas d’apprécier le taux de récidive et incite à la réalisation d’essais cliniques.
Pour plus d’informations, consulter :
- Contet-Audonneau N, Schmutz JL, Basile AM, de Bièvre C. A new agent of onychomycosis in the elderly: Onychocola canadensis. Eur J Dermatol. 1997;7(2):115–7.
- Fanti F, Conti S, Zucchi A, Polonelli L. First Italian report of onychomycosis caused by Onychocola canadensis. Med Mycol. 2003 Oct;41(5):447–50.
- Gibas CF, Sigler L, Summerbell RC, Hofstader SL, Gupta AK. Arachnomyces kanei (anamorph Onychocola kanei) sp. nov., from human nails. Med Mycol. 2002;40(6):573–80.
- Gupta AK, Horgan-Bell CB, Summerbell RC. Onychomycosis associated with Onychocola canadensis: ten case reports and a review of the literature. J Am Acad Dermatol. 1998;39(3):410–7.
- Gupta AK, Gregurek-Novak T, Konnikov N, Lynde CW, Hofstader S, Summerbell RC. Itraconazole and terbinafine treatment of some nondermatophyte molds causing onychomycosis of the toes and a review of the literature. J Cutan Med Surg. 2001;5(3):206–10.
- Sigler L, Congly H. Toenail infection caused by Onychocola canadensis gen. et sp. nov. J Med Vet Mycol. 1990;28(5):405–17.
Yohann Le Govic et Anne Totet
(CHU Amiens-Picardie, Parasitologie et Mycologie & Université de Picardie Jules Verne, UR 4294)