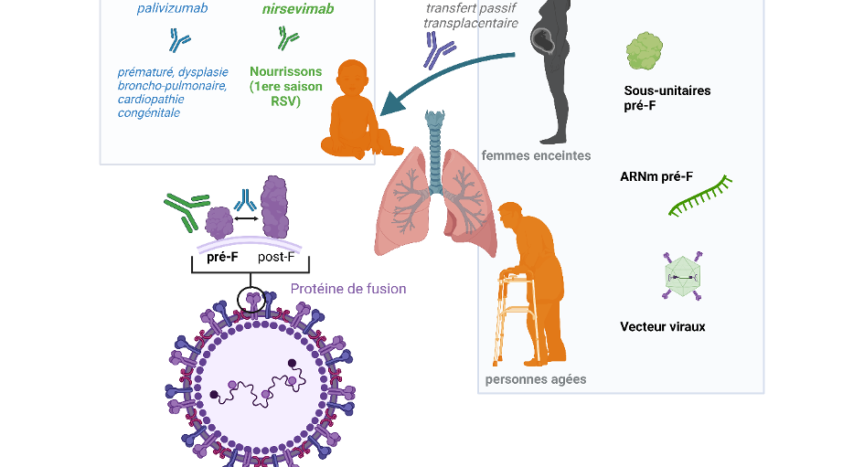
En cette fin d’année marquée par l’intensité de l’épidémie de bronchiolite et les problèmes qui en résultent dans les services de pédiatrie, il est intéressant de constater qu’il y a du mouvement sur le front de la prévention des infections par le RSV. Le développement de stratégies préventives par immunoprophylaxie passive (anticorps monoclonaux, AcM) ou vaccination a bénéficié ces dernières années d’une meilleure connaissance de l’immunité anti-RSV. L’obtention d’une forme stabilisée de la protéine de fusion (protéine F) du RSV en conformation pré-fusion (pré-F) a notamment permis l’identification d’épitopes viraux cibles d’une réponse intense médiée par des anticorps neutralisants (AcN)(Mazur et al. 2022).
A ce jour, seul le palivizumab, un AcM humanisé recombinant dirigé contre un épitope conservé de la protéine F, est indiqué pour la prévention des infections respiratoires basses graves dues au RSV nécessitant une hospitalisation chez les enfants à risque élevé (nés avant 35 SA et de moins de 6 mois au début de l’épidémie, enfants de moins de 2 ans atteints de cardiopathie congénitale avec retentissement hémodynamique ou dysplasie bronchopulmonaire).
Un nouvel AcM, le nirsevimab, a obtenu le 31 octobre 2022 l’autorisation de l’Agence Européenne du médicament pour la prévention des infections par le RSV chez les jeunes enfants. Il s’agit d’un AcM monoclonal recombinant d’isotype IgG1k qui cible la conformation pré-F de la protéine F du RSV, modifié de façon à avoir une demi-vie plasmatique longue et actif sur les RSV de types A et B. Cette autorisation est basée sur les résultats d’études cliniques menées chez des enfants prématurés ou nés à terme et plus récemment chez des nourrissons avec une pathologie à risque d’infection sévère par le RSV. Le traitement consiste en une injection intra-musculaire unique chez les enfants nés avant ou pendant la saison épidémique de circulation du RSV. L’étude de phase IIb, publiée en 2020, menée dans 23 pays, était une étude randomisée en double aveugle traitement contre placebo, ratio 2:1, réalisée chez 1453 enfants nés prématurément (i.e. entre 29 et 35 semaines d’aménorrhée [SA]). Dans cette étude, 2,5% des enfants traités par nirsevimab (n=25/949) ont présenté une infection par le RSV nécessitant une prise en charge médicale dans les 150 jours post-injection contre 9,5% dans le groupe placebo (n=46/484) (Griffin et al. 2020). Dans l’essai de phase III (Melody) mené dans 21 pays chez 1490 nourrissons en bonne santé nés à terme ou peu prématurés (35 semaines de gestation ou plus), 1,2% des enfants traités par nirsevimab (n=12/994) ont présenté une infection par le RSV nécessitant une prise en charge médicale dans les 150 jours post-injection contre 5% dans le groupe placebo (n=25/496) (Hammitt et al. 2022). L’analyse groupée de ces deux essais montre une diminution de 77,3% (intervalle de confiance à 95% [50,3 ; 89,7] ; P<0,001) des hospitalisations pour infections des voies respiratoires inférieures causées par le RSV.
Parallèlement, plusieurs candidats vaccins sont en évaluation clinique dont certains en phase III : des vaccins sous-unitaires pré-F (RSVPre-F3 [GSK] ; RSVPreF [Pfizer]), un vaccin ARNm pré-F (mRNA-1345 [Moderna]) et des vaccins à vecteur recombinant (MVA-BN RSV [Bavarian Nordic] ; AD26.RSV.PreF [Johnson et Johnson]). Ces vaccins sont évalués dans deux populations : les femmes enceintes, avec l’objectif de protéger les nourrissons pendant les premiers mois de vie, et les personnes âgées, à risque d’infections respiratoires sévères par le RSV. Les données préliminaires récemment publiées pour un des vaccins sous-unitaires (RSVpre-F [Pfizer]) montrent une bonne tolérance pendant la grossesse, des titres élevés d’AcN et la transmission de ces AcN au nouveau-né et suggèrent une protection vis-à-vis des infections pendant les premiers mois de vie (Simões et al. 2022).
Le positionnement de ces différentes stratégies chez les populations à risque sera à évaluer dans les années qui viennent. Leur déploiement éventuel devra s’accompagner d’une surveillance génomique virale accrue pour détecter l’émergence de mutations associées à un échappement à l’action des anticorps neutralisants. Une autre problématique est leur accessibilité dans les pays à revenu faible, alors que c’est dans ces pays que la mortalité infantile en lien avec les infections par le RSV est la plus importante. A suivre donc …