Le cytomégalovirus humain : vers de nouvelles stratégies thérapeutiques
Le cytomégalovirus humain (CMVH) est un bêta-herpèsvirus infectant 50 à 100 % de la population mondiale, la prévalence variant en fonction du niveau socio-économique. A ce jour, le CMVH reste une cause majeure de morbidité et de mortalité en transplantation et un pathogène opportuniste majeur chez les patients au stade SIDA. Le CMVH est aussi la première cause d’infection congénitale d’origine virale 1. Les antiviraux actuellement disponibles en pratique clinique sont peu nombreux. Le ganciclovir, et sa prodrogue orale, le valganciclovir, le cidofovir et le foscarnet inhibent l’activité de l’ADN polymérase virale pUL54. Bien qu’efficaces, ces antiviraux présentent une toxicité hématologique et/ou rénale, entraînent l’émergence de mutations de résistance et sont contre-indiqués pendant la grossesse. Une nouvelle molécule, le létermovir (ou PREVYMISTM), cible une étape du cycle de multiplication virale, l’encapsidation, en interagissant avec le complexe terminase. Cette molécule a reçu une AMM (autorisation de mise sur le marché) pour une utilisation en prophylaxie dans le cadre de greffes de cellules souches hématopoïétiques. Néanmoins, des mutations de résistance ont été détectés au sein des partenaires du complexe terminase, son mécanisme d’action n’est, à ce jour, pas complétement élucidé et aucune activité n’est observée contre les autres herpèsvirus (action spécifique de cette molécule sur le complexe terminase du CMVH). Il est donc essentiel de caractériser précisément les protéines du CMVH impliquées dans des étapes clés de la multiplication virale, ces dernières constituant de potentielles cibles thérapeutiques.
La réplication du génome du CMVH aboutit à la formation de concatémères d’ADN qui agissent comme substrat lors du processus d’encapsidation. Le complexe terminase, permet la reconnaissance, le clivage et la translocation des unités de génome dans des capsides néoformées. Le génome du CMVH comporte, à ses extrémités et en son centre, des séquences répétées, appelées séquences « a », qui contiennent des éléments cis-régulateurs (« pac » ou « cis-acting packaging element »). Le processus d’encapsidation implique un clivage site-spécifique au niveau de séquences riches en AT des éléments « pac ». Le complexe terminase, hétéro-oligomérique, est constitué de la grande sous-unité pUL56 et de la petite sous-unité pUL89. Au moins quatre protéines supplémentaires, pUL51, pUL52, pUL77 et pUL93, joueraient un rôle essentiel dans l’étape d’encapsidation du génome viral, mais leurs fonctions biologiques restent mal caractérisées. Après sa translocation dans le noyau, le complexe terminase reconnaît les séquences « pac », effectue un premier clivage de l’ADN viral, et recrute une capside vide. Il réalise alors un second clivage libérant l’ADN viral dans la capside via une interaction avec les protéines pUL104 (protéine portail de la capside). Le complexe se dissocie finalement, permettant une nouvelle encapsidation 2,3. Bien que pUL56 soit la protéine présentant le plus grand nombre de fonctions et de zones d’interactions parmi les protéines du complexe terminase, peu de données existent sur celle-ci.
Une équipe de recherche – Pr Sophie Alain, Dr Sébastien Hantz, Dr Gaëtan Ligat (Anti-Infectieux : supports moléculaires des résistances et innovations thérapeutiques, UMR Inserm 1092, Université de Limoges) – a réussi à identifier différentes cibles virales au sein de la sous-unité pUL56, qui pourraient, à l’avenir, ouvrir de nouvelles perspectives thérapeutiques. Les résultats de ces travaux, ont été publiés (Ligat et al., 2017, 2019) et font l’objet d’un brevet porté par l’Inserm Transfert (WO2019020480).
L’équipe a récemment proposé que la sous-unité pUL56 appartiendrait à la famille des « LAGLIDADG homing endonucleases » (LHE). Les auteurs ont en effet mis en évidence, dans la partie N-terminale de la protéine, un motif 134LATLNDIERFL144 se rapprochant du motif LAGLIDADG des LHE, et un motif de liaison à l’ADN (C191-X2-C194-X22-C217-X-H219) 4. Les auteurs ont également montré qu’une courte séquence localisée dans la région C-terminale de pUL56 (671WMVVKYMGFF680) est essentielle pour l’interaction des sous-unités pUL56 et pUL89 5.
Les auteurs ont donc mis en évidence pour la première fois de nouveaux motifs au sein de pUL56, grande sous-unité du complexe terminase du CMVH, susceptibles de représenter des cibles prometteuses pour de futurs traitements.
Contacts :
Pr Sophie Alain sophie.alain@unilim.fr
Dr Sébastien Hantz sebastien.hantz@unilim.fr
Dr Gaëtan Ligat gligat@unistra.fr
Références :
- Mazeron MC, Alain S, Leruez-Ville M, et al. Infections à cytomégalovirus. EMC – Mal Infect 2015;12(4):1–16.
- Ligat G, Cazal R, Hantz S, et al. The human cytomegalovirus terminase complex as an antiviral target: a close-up view. FEMS Microbiol Rev 2018;42:137–145.
- Ligat G, Muller C, Alain S, et al. [The terminase complex, a relevant target for the treatment of HCMV infection]. Med Sci MS 2020;36:367–375.
- Ligat G, Couvreux A, Cazal R, et al. Highlighting of a LAGLIDADG and a Zing Finger Motifs Located in the pUL56 Sequence Crucial for HCMV Replication. Viruses 2019;11.
- Ligat G, Jacquet C, Chou S, et al. Identification of a short sequence in the HCMV terminase pUL56 essential for interaction with pUL89 subunit. Sci Rep 2017;7:8796.
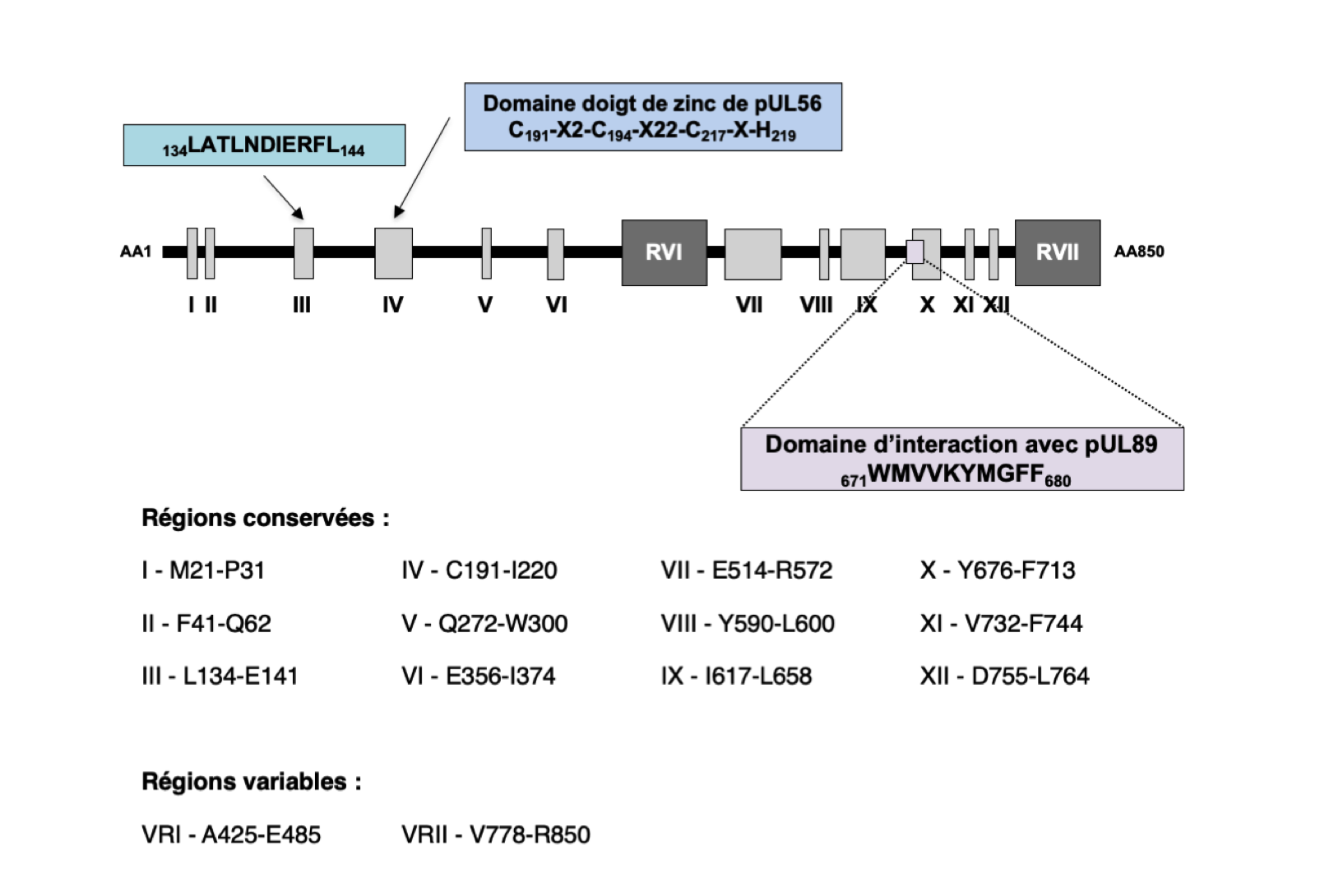
Régions conservées de la sous-unité pUL56 adaptées de 2,3. pUL56 est composée de 12 régions conservées (I-XII). La région III comprend un motif 134LATLNDIERFL144 caractéristique des « LAGLIDADG homing endonucléases ». La région IV représente un domaine doigt de zinc C191-X2-C194-X22-C217-X-H219. La partie centrale de pUL56 et l’extrémité C-terminale comprennent deux régions variables annotées RVI et RVII. Une séquence localisée dans la région C-terminale (671WMVVKYMGFF680) est essentielle pour l’interaction des sous-unités pUL56 et pUL89.