Parmi les produits naturels, les terpénoïdes (isoprénoïdes) constituent l’un des groupes de molécules les plus importants et les plus diversifiés du vivant avec plus de 50 000 structures distinctes décrites à ce jour. Ces composés sont impliqués dans une extrême diversité de fonctions biologiques chez tous les organismes, allant du développement aux interactions intra- et interspécifiques. Les terpénoïdes sont également bien connus pour leurs multiples propriétés biologiques qui ont été exploitées par l’homme depuis des décennies sous forme de parfums (par exemple le géraniol la rose), de composés industriels (par exemple le colorant alimentaire β-carotène) ou de produits pharmaceutiques (par exemple, l’artémisinine, un médicament antipaludéen). Bien que leur structure soit extrêmement variable, tous les terpénoïdes proviennent de la condensation tête-bêche des unités de base à cinq carbones isopentényl diphosphate (IPP) et de son isomère diméthylallyl diphosphate (DMAPP) (Figure 1).
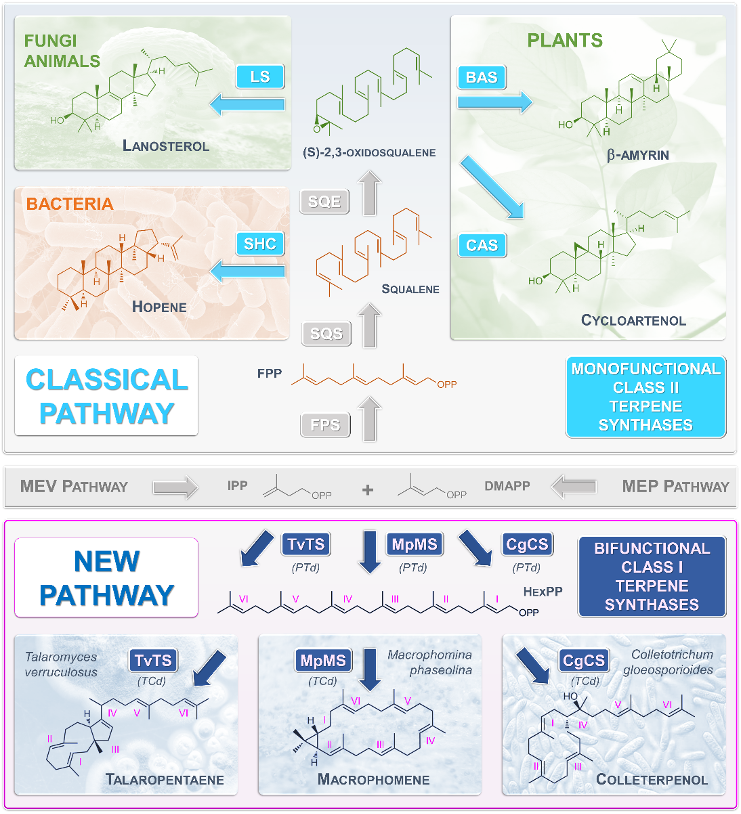
Au fil des années, l’étude de la biosynthèse des terpénoïdes a mis en lumière des surprises exceptionnelles, faisant apparaitre de nouveaux mécanismes de biosynthèse terpénique dans la littérature, comme l’illustrent les derniers travaux des groupes d’Abe, Dickschat et Liu concernant la synthèse des triterpénoïdes. Cette classe de terpénoïdes en C30 largement représentée dans l’arbre du vivant comprend par exemple le cholestérol des mammifères et les hormones stéroïdes, l’ergostérol chez les champignons, les brassinostéroïdes et les saponines chez les plantes, ainsi que les hopanoïdes chez les bactéries. Tous les triterpènes connus sont générés par des triterpène synthases à partir de squalène (hopanoïdes, bactériens) ou d’oxydosqualène (triterpènes animaux, fongiques et végétaux). La cyclisation de ces deux squelettes linéaires en C30 est ensuite catalysée par des terpène synthases de classe II (TS) spécifiques pour donner les principaux précurseurs de stéroïdes (par exemple, l’hopéne pour les bactéries ou le lanostérol pour les animaux et les champignons) (Figure 1). Ces TS de type II divergent considérablement des TS de type I pour la conversion des squelettes C10 à C25 en terpénoïdes cycliques. Il est important de noter qu’une autre voie de biosynthèse des triterpènes indépendante du squalène peut reposer sur la cyclisation du précurseur largement distribué, l’hexaprényl diphosphate (HexPP, C30) (Figure 1). Cependant, les enzymes spécifiques impliquées dans la cyclisation de l’HexPP restaient jusqu’à présent inconnues. En se concentrant sur les triterpènes synthases fongiques chimériques de classe I, Tao et ses collègues ont identifié le chaînon manquant entre la large distribution de HexPP et son rôle de précurseur des triterpénoïdes.
À l’aide d’une plate-forme de levure précédemment développée dédiée à la caractérisation de TS, trois nouvelles TS bifonctionnelles ont été identifiées chez des espèces fongiques : la talaropentaene synthase (TvTS) de l’endophyte Talaromyces verruculosus, la macrophène synthase (MpMS) du phytopathogène Macrophomina phaseolina ainsi que la collertepenol synthase de Colletotrichum gloeosporioides (Figure 1).
Dans l’ensemble, les nouvelles données rapportées par les groupes de recherche d’Abe, Disckschat et Liu représentent évidemment une avancée majeure dans le domaine du métabolisme secondaire. En effet, alors que les investigations menées ces dernières années ont activement fait progresser nos connaissances concernant les voies de biosynthèse des triterpènes dérivés du squalène, la machinerie enzymatique conduisant à la production de triterpènes cycliques à partir de substrats diphosphates restait inconnue jusqu’à présent. Au-delà de l’enrichissement de notre compréhension de la biosynthèse des terpènes dans la nature, nous pouvons anticiper que ces découvertes trouveront des applications en biotechnologie industrielle.
Pour la section mycologie : Marie-Noëlle Rosso, Arnaud Fekkar, Nicolas Papon