Comment ne pas résister à Aspergillus ?
Parmi les espèces fongiques d’importance critique en tête de la liste prioritaires de l’Organisation Mondiale de la Santé (OMS) se trouve Aspergillus fumigatus, un champignon saprophyte omniprésent dans notre environnement. En filtrant quotidiennement plus de 10 000 litres d’air non stérile, nos poumons inhalent des milliers de spores de cette moisissure. Bien que la clairance mucociliaire assure une expulsion mécanique efficace d’une quantité importante de ces particules, les petites spores d’A. fumigatus peuvent facilement rester coincées dans nos alvéoles pulmonaires. Pourtant, il est surprenant de constater que la plupart des humains ne développent aucune maladie attribuable à A. fumigatus et ne présentent aucun signe d’immunité acquise contre ce micro-organisme. Il semblerait donc que pour la plupart des individus en bonne santé, la réponse immunitaire locale innée soit suffisante pour nettoyer l’organisme sans nécessiter l’intervention d’une immunité acquise.
Les facteurs de risque prédisposant aux aspergilloses sont désormais bien connus, en particulier un qualitatif ou quantitatif en neutrophiles, soulignant le rôle majeur de ces globules blancs comme première ligne de défense pour lutter naturellement contre A. fumigatus. Cependant, les patients non neutropéniques des unités de soins intensifs recevant une corticothérapie systémique à long terme tout comme les personnes immunocompétentes touchées par une insuffisance respiratoire aiguë (provoquée par le virus influenza A ou IAV de la grippe et le SARS-CoV-2) peuvent également développer des infections par A. fumigatus potentiellement mortelles. Ceci suggère que d’autres acteurs que les neutrophiles pourraient agir dans le maintien de la résistance pulmonaire essentielle de l’hôte contre cette moisissure. En somme, bien que les divers facteurs de risque de perte des défenses contre A. fumigatus et le rôle essentiel des neutrophiles dans la destruction de cet agent pathogène fongique soient bien connus, la relation mécanistique qui pourrait expliquer les diverses conditions prédisposant à la perte de résistance aux infections mortelles par A. fumigatus restait jusqu’alors inconnue. Dans ce champ thématique, le groupe de recherche de Bryan G. Yipp vient de publier des avancées majeures dans la revue Science Translational Medicine. Globalement, toutes les données compilées dans cet article suggèrent que lors d’une infection par l’IAV ou le SARS-CoV-2 ou encore suite à un traitement par corticoïdes, l’immunité innée dirigée contre A. fumigatus est perturbée et résulte de la mort des lymphocytes B1a entraînant à son tour une déplétion en anticorps IgG spécifiques anti-A. fumigatus, permettant ainsi au champignon de rester caché des neutrophiles pulmonaires recrutés, et laissant la porte ouverte à la germination du champignon et à l’invasion des tissus (Figure 1).
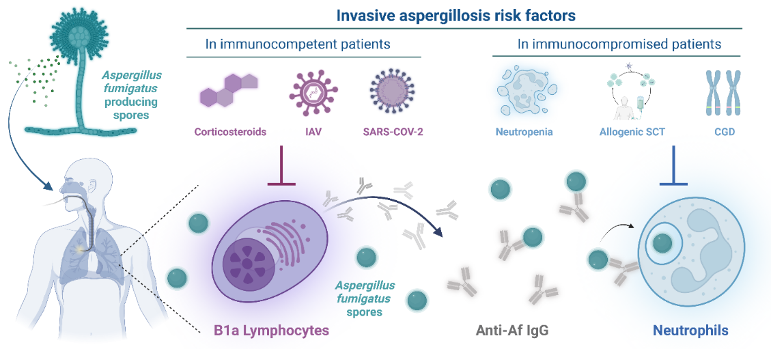
Figure 1. Une nouvelle voie de résistance aux infections à Aspergillus fumigatus. Les facteurs de risque prédisposant aux infections à A. fumigatus sont désormais bien connus et incluent principalement les patients immunodéprimés, comme ceux qui souffrent de neutropénie, qui subissent une transplantation de cellules souches allogéniques (SCT pour stem cell transplantation) ou qui souffrent de granulomatose chronique (CGD pour chronic granulomatous disease) (encadré en haut à droite). Les patients immunocompétents recevant une corticothérapie systémique à long terme ou atteints d’une pneumonie due au coronavirus du syndrome respiratoire aigu sévère 2 (SARS-CoV-2) ou au virus influenza A (IAV) (panneau supérieur gauche) peuvent également développer des infections par A. fumigatus. Sarden et ses collègues ont détaillé la relation mécaniste qui explique les diverses conditions prédisposant à la perte de résistance aux infections mortelles par A. fumigatus en mettant en évidence un axe lymphocytes B1a – IgG naturelles anti-A. fumigatus – neutrophiles (panneau inférieur) régissant la résistance innée à ce pathogène fongique. Figure tirée de Gangneux JP, Hoenigl M, Papon N. How to lose resistance to Aspergillus infections. Trends Microbiol. 2023 Mar;31(3):222-224. doi: 10.1016/j.tim.2023.01.008. Epub 2023 Feb 6. PMID: 36754763.
Il est important de saluer que cette étude fournit une explication mécanistique originale de la rupture de la résistance à l’aspergillose dans au moins trois contextes cliniques distincts. L’identification de nouveaux acteurs s’ajoutant aux neutrophiles et la découverte de voies coopératives essentielles impliquées dans la défense naturelle contre A. fumigatus dévoilent désormais la relation fonctionnelle qui pourrait relier et expliquer une multitude de facteurs de risque prédisposant à cette infection fongique fréquemment mortelle. Cet article ouvre ainsi non seulement des perspectives passionnantes dans le domaine du diagnostic, compte tenu de la possibilité de stratifier le risque d’aspergillose mortelle en déterminant la concentration d’IgG anti-A. fumigatus dans le sérum des patients, mais également en thérapeutique en utilisant des sérums provenant de donneurs sains.
Pour la section mycologie : Marie-Noëlle Rosso, Arnaud Fekkar, Jean-Pierre Gangneux, Nicolas Papon






