La réponse immunitaire innée constitue la première ligne de défense antivirale de l’hôte en limitant la diffusion des virus au sein de l’organisme et en participant à la mise en place de la réponse immunitaire adaptative. Parmi les mécanismes cellulaires de l’immunité innée, il existe des senseurs ou PRRs (pattern recognition receptors) capables de reconnaître des motifs viraux conservés (acides nucléiques ou glycoprotéines) appelés PAMPs (pathogen-associated molecular patterns) et d’induire une cascade d’activation au sein de la cellule infectée aboutissant à la synthèse de nombreuses molécules de défense antivirale comme les interférons et les cytokines pro-inflammatoires. Les TLRs (Toll-like receptors) sont les mieux connus de ces senseurs impliqués dans la réponse immunitaire innée et inflammatoire. Un défaut d’origine génétique dans la mise en place de cette réponse cellulaire antivirale pourrait donc être responsable d’une plus grande sensibilité de l’hôte à certaines infections. Cette thématique a notamment été étudiée dans le cadre des atteintes neurologiques virales. En 2006, la première association entre un défaut génétique touchant la voie de signalisation cellulaire TLR3 et l’encéphalite due au virus herpes simplex (HSV) a été publiée : il s’agissait d’une mutation du gène UNC93B identifiée chez deux enfants. Depuis, d’autres mutations dans différents gènes codant des protéines impliquées dans cette voie de signalisation et induisant une plus grande sensibilité à l’encéphalite herpétique ont été caractérisées à la fois chez des enfants et des adultes [1] (Figure 1). Beaucoup plus récemment, un senseur impliqué dans la réponse cellulaire vis-à-vis du virus de la varicelle et du zona (VZV) a été identifié. Il s’agit de l’ARN polymérase III (POL III), enzyme constituée de 10 sous-unités catalytiques assurant la transcription de gènes cellulaires. Des mutations ont été identifiées dans les gènes codant certaines sous-unités de la POL III (POLR3A, POLR3E, POLR3F) chez des patients, enfants et adultes, présentant des atteintes neurologiques graves dues au VZV [2-3]. L’ensemble de ces résultats soulignent l’importance des facteurs de prédisposition génétique de l’hôte dans la survenue des atteintes neurologiques graves par HSV et VZV. Toutefois, la pénétrance clinique incomplète de ces mutations suggère que d’autres facteurs (âge, facteurs de virulence, dose infectieuse …) sont également impliqués. De nombreux travaux de recherche doivent encore être menés afin d’élucider le rôle précis de ces senseurs cellulaires dans la survenue des manifestations neurologiques graves dues aux alphaherpèsvirus.
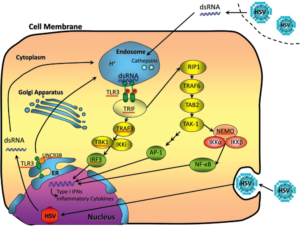
Figure 1. Représentation schématique du devenir et de la voie de signalisation du TLR3 (Toll-like receptor 3) dans les cellules. Le ligand TLR3 – ARN double brin (ARNdb) peut être obtenu à partir de cellules infectées par le HSV ou apparaître comme intermédiaire de réplication au cours d’une infection de la cellule par HSV. Ensuite, l’ARNdb est délivré à l’endosome, où il s’associe au récepteur. Lors de la dimérisation et de la phosphorylation, TLR3 déclenche des cascades de signalisation conduisant à l’activation des facteurs de transcription : facteur de régulation de l’interféron 3 (IRF3), facteur nucléaire-kB (NF-kB) et protéine activatrice-1 (AP-1), déclenchant la production d’IFN de type I et de cytokines inflammatoires. Les protéines impliquées dans les voies de signalisation ci-dessus, dans lesquelles les altérations signalées peuvent conduire à l’apparition d’encéphalite herpétique, sont soulignées en rouge [1].
- Mielcarska MB, Bossowska-Nowicka M, Toka FN. Functional failure of TLR3 and its signaling components contribute to herpes simplex encephalitis. J Neuroimmunol 2018 ; 316 : 65-73. PMID : 29305044
- Carter-Timofte ME, Hansen AF, Mardahl M, Fribourg S, Rapaport F, Zhang SY, Casanova JL, Paludan SR, Christiansen M, Larsen CS, Mogensen TH. Varicella-zoster virus CNS vasculitis and RNA polymerase III gene mutation in identical twins. Neurol Neuroimmunol Neuroinflamm 2018 ; 5 : e500. PMID : 30211253
- Carter-Timofte ME, Hansen AF, Christiansen M, Paludan SR, Mogensen TH. Mutations in RNA polymerase III genes and defective DNA sensing in adults with varicella-zoster virus CNS infection. Genes and Immunity 2019 ; 20 : 214-223. PMID : 29728610
Dr David BOUTOLLEAU
david.boutolleau@aphp.fr
Responsable du Centre National de Référence Herpèsvirus (laboratoire associé)
Service de Virologie, Hôpital Pitié-Salpêtrière, Groupe Hospitalo-Universitaire (GHU) AP-HP.
Sorbonne Université, Paris








